Schmerztherapie
Opioid-induzierte Obstipation
Eine funktionelle Obstipation kann durch verschiedene Risikofaktoren verursacht werden1:
- Alter: > 70 Jahre
- Geschlecht: Frauen > Männer
- Balaststoffarme Ernährung
- Unregelmäßige Stuhlganggewohnheiten
- Wenig oder mangelnde körperliche Aktivität
- Psychischer Zustand: Angst und Depression
- Schlechte Schlafqualität
Eine Obstipation kann aber auch durch die Einnahme von Opioiden, wie etwa in einer Schmerztherapie, entstehen. Opioide aktivieren die Opioid-Rezeptoren im Darm, die ubiquitär im Gastrointestinal Trakt verteilt sind.2
Bei Patienten mit Obstipation, die eine Opioid-Therapie erhalten, sollte eine Opioid-induzierte Obstipation (Opioid-Induced Constipation, OIC) als Differenzialdiagnose in Betracht gezogen werden.3
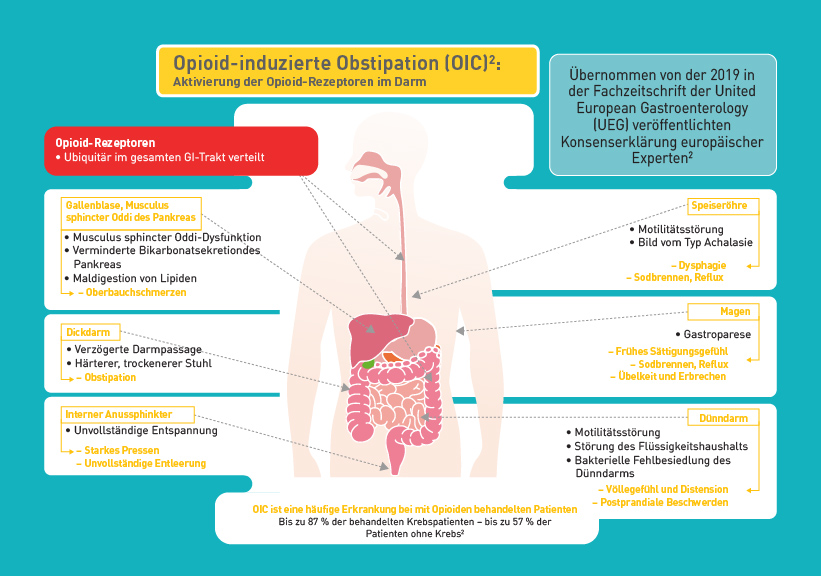
Zur Pathophysiologie und den Auswirkungen der OIC gehört die Beeinträchtigung der motorischen Funktion2:
- Gehemmte Freisetzung der Neurotransmitter, die propulsive Kontraktionen stimulieren
- Stimulierte Entspannung der Verdauungsorgane
- Verstärkung des Schließmuskelverschlusses
Dadurch verlangsamt sich die orozökale und die Dickdarm-Transitzeit. Außerdem erhöht sich der Schließmuskeltonus, insbesondere im Analkanal.
Gleichzeitig wird die Sekretion beeinträchtigt2:
- Reduzierte Magensekrete, besonders im Dickdarm
- Reduktion der Chlorid-Ionen im Lumen des Magen-Darm-Trakts
- Erhöhte Wasserabsorption durch Darmstauung
Daraus resultiert harter, trockener Stuhl, was zu starkem Pressen beim Stuhlgang und dem Gefühl einer unvollständigen Entleerung führt.
Zu den zusätzlichen Einschränkungen für die Patienten zählen:
- Potenzial für einen stark nachteiligen Einfluss auf die Lebensqualität
- Risiken für eine schlechte Adhärenz bei der schmerzlindernden Behandlung
- Kann zum Abbruch der Opioid-Behandlung führen
Schwache Opioide (Stufe II) oder starke Opioide (Stufe III) können in ähnlichem Maße Obstipation verursachen4 Obstipation kann auftreten oder sich verschlimmern, wenn eine Opioid-Therapie eingeleitet, geändert oder erhöht wird.5 Die Schwere der Obstipation ist nicht dosisabhängig.6
Diagnose
1. Neue oder sich verschlechternde Symptome einer Obstipation bei Beginn, Änderung oder Erhöhung der Opioid-Therapie, die zwei oder mehr der folgenden Punkte umfassen müssen:
- Starkes Pressen bei mehr als 25 % der Stuhlgänge
- Klumpiger oder harter Stuhl (Bristol-Stuhlform-Skala 1–2) bei mehr als 25 % der Stuhlgänge
- Gefühl einer unvollständigen Entleerung bei mehr als 25 % der Stuhlgänge
- Gefühl einer anorektalen Obstruktion/Blockade bei mehr als 25 % der Stuhlgänge
- Manuelle Manöver zur Erleichterung des Stuhlgangs bei mehr als 25 % der Stuhlgänge (z. B. Entleerung mithilfe der Finger, Stützung des Beckenbodens)
- Weniger als drei spontane Stuhlgänge pro Woche
2. Ohne die Anwendung von Abführmitteln kommt es selten zu lockerem Stuhl.

Häufige Fragen
Wie häufig tritt opioidinduzierte Obstipation bei Patienten unter Opioidtherapie auf?
Die Prävalenz ist hoch und variiert je nach Population und Dosis: Bei chronischen Nichttumorschmerzen sind rund 40 % betroffen, bei Tumorschmerzpatienten – abhängig von Dosis und Kontext – deutlich mehr. Die hohe Häufigkeit unterstreicht die Notwendigkeit einer frühzeitigen Prophylaxe und strukturierten Diagnostik.
Quellen:
Welche diagnostischen Instrumente eignen sich zur Beurteilung einer OIC?
Der Bowel Function Index (BFI) ist ein validiertes Instrument zur Diagnose und Verlaufskontrolle der OIC; er erfasst Defäkationsschwierigkeiten, das Gefühl inkompletter Entleerung und die subjektive Obstipationsbelastung. Klinisch können ergänzend die Rom‑IV‑Kriterien zur Einordnung genutzt werden.
Quellen:
- AWMF. S3‑Leitlinie LONTS: Langzeitanwendung von Opioiden bei chronischen nicht‑tumorbedingten Schmerzen. 2020. Registernr. 145‑003. (Zugriff: 10.02.2026)
- Becker E, Madi MY, Magee M, et al. Opioid‑induced constipation: mechanisms and management. Postgrad Med J. 2025. doi:10.1093/postmj/qgaf211.
Welche Basismaßnahmen sollten bei Verdacht auf OIC eingeleitet werden?
Leitlinien empfehlen als Stufe 0 eine ausreichende Flüssigkeitszufuhr, ballaststoffreiche Ernährung und Förderung körperlicher Aktivität. Diese Maßnahmen sind sinnvoll zur Prophylaxe und bei milden Beschwerden, reichen bei manifester OIC jedoch häufig nicht aus.
Quellen:
Welche Rolle spielen konventionelle Laxanzien in der Therapie der OIC?
Konventionelle Laxanzien (stimulierend und osmotisch) sind Mittel der ersten Wahl. Sie verbessern die Stuhlfrequenz, wirken jedoch nicht kausal gegen eine durch Opioide verursachte Motilitäts‑ und Sekretionshemmung, sodass bei unzureichendem Effekt eine Eskalation erforderlich ist.
Quellen:
- AWMF. S3‑Leitlinie LONTS. 2020. Registernr. 145‑003. (Zugriff: 10.02.2026)
- Becker E, Madi MY, Magee M, et al. Postgrad Med J. 2025. doi:10.1093/postmj/qgaf211.
Wann sind periphere µ‑Opioidrezeptor‑Antagonisten (PAMORA) indiziert?
PAMORA werden empfohlen, wenn konventionelle Laxanzien nach angemessenem Einsatz unzureichend wirken. Sie antagonisieren periphere µ‑Opioidrezeptoren im Darm und verbessern OIC, ohne die zentrale Analgesie zu beeinflussen.
Quellen:
- DGS. Praxisleitlinie: Opioidinduzierte Obstipation. 2019. (Zugriff: 10.02.2026)
- Li Y, Tu Y, Zhou Z, et al. Efficacy and safety of opioid‑receptor antagonists for OIC: a systematic review and meta‑analysis. Front Pharmacol. 2026;16:1749875. doi:10.3389/fphar.2025.1749875.
Welche klinischen Risiken birgt eine unbehandelte OIC?
Unbehandelte OIC kann zu ausgeprägten Bauchschmerzen, Stuhlverhalt sowie massiver Stuhlverhärtung mit Darmblockade führen. Dies beeinträchtigt die Lebensqualität erheblich und ist ein häufiger Grund für Dosisreduktionen oder das Absetzen der Opioidtherapie. Zudem kann OIC die Entwicklung eines mechanischen oder paralytischen Ileus begünstigen – eine potenziell lebensbedrohliche Komplikation, die eine sofortige notfallmedizinische Behandlung erfordert.
Quellen:
- Andresen V, Wedel T. Arzneiverordnung in der Praxis. 2016;1:12‑20.
- DGS. Praxisleitlinie: Opioidinduzierte Obstipation. 2019. (Zugriff: 10.02.2026)
- Gupta N, Powell J, et al. POP GOES THE ILEUS: OPIOID‑INDUCED ILEUS COMPLICATED BY PERFORATION. CHEST. 154(4):587A.
Welche Patientengruppen haben ein erhöhtes Risiko für eine OIC?
Erhöhte Risiken bestehen bei höherem Alter, bestehenden Motilitätsstörungen und insbesondere bei höheren Opioiddosen. Tumorschmerzpatienten zeigen aufgrund höherer Analgetikabelastung häufig eine höhere OIC‑Prävalenz.
Quellen:
- DGS. Praxisleitlinie: Opioidinduzierte Obstipation. 2019. (Zugriff: 10.02.2026)
- Yimer BB, Soomro M, McBeth J, et al. Comparative risk of severe constipation in patients treated with opioids for non‑cancer pain: a retrospective cohort study. BMC Med. 2025;23:288. doi:10.1186/s12916-025-04118-7.
Welche Bedeutung hat die Opioiddosis für das OIC‑Risiko?
Das Obstipationsrisiko steigt dosisabhängig; ab etwa ≥ 50 Morphinmilligramm‑Äquivalent pro Tag ist eine signifikante Zunahme schwerer Obstipation belegt. Dies unterstreicht die Notwendigkeit einer sorgfältigen Dosissteuerung und regelmäßigen Reevaluation.
Quellen:
- Yimer BB, Soomro M, McBeth J, et al. BMC Med. 2025;23:288. doi:10.1186/s12916-025-04118-7.
- Becker E, Madi MY, Magee M, et al. Postgrad Med J. 2025. doi:10.1093/postmj/qgaf211.
Welche standardisierten Therapiealgorithmen empfehlen Leitlinien für OIC?
Leitlinien empfehlen ein Stufenschema: Basismaßnahmen, Laxanzien (ggf. Kombination unterschiedlicher Wirkprinzipien) und bei unzureichendem Ansprechen PAMORA. Die S2k‑Leitlinie zur chronischen Obstipation widmet der OIC ein eigenes Kapitel mit detailliertem Algorithmus.
Quellen:
Welche Auswirkungen hat OIC auf Lebensqualität und Therapieadhärenz?
OIC reduziert die Lebensqualität und ist ein zentraler Grund für Therapieabbrüche unter Opioiden. Dies kann die Schmerzversorgung destabilisieren und zusätzliche Versorgungsaufwände nach sich ziehen.
Quellen:
- Andresen V, Wedel T. Arzneiverordnung in der Praxis. 2016;1:12‑20.
- DGS. Praxisleitlinie: Opioidinduzierte Obstipation. 2019.
Welche Evidenz stützt den Einsatz von Opioidrezeptor‑Antagonisten bei OIC?
Aktuelle Meta‑Analysen zeigen eine signifikante Zunahme spontaner Stuhlentleerungen, höhere Responderraten sowie Verbesserungen von Lebensqualität und Behandlungszufriedenheit. Das Risiko schwerer Nebenwirkungen unterscheidet sich dabei nicht signifikant von Placebo; gastrointestinale Nebenwirkungen sind häufiger, aber meist handhabbar.
Quellen:
- Li Y, Tu Y, Zhou Z, et al. Front Pharmacol. 2026;16:1749875. doi:10.3389/fphar.2025.1749875.
- Wobbe B, Gerner M, Köhne CH. Safety of naldemedine for opioid‑induced constipation – a systematic review and meta‑analysis. J Pain Palliat Care Pharmacother. 2024;38(4):ePub ahead of print. doi:10.1080/15360288.2024.2427324.
Referenzen
- Chen Z, Peng Y, Shi Q et al. Prevalence and risk factors of functional constipation according to the Rome criteria in China: a systematic review and meta-analysis. Frontiers in Medicine February 2022 Volume 9
- Farmer AD, Drewes AM, Chiarioni G et al. Pathophysiology and management of OIC: European expert consensus statement UEG Journal. 2019;7(1):7–20
- Serra J, Pohl D, Azpiroz F et al. European society of neurogastroenterology and motility guidelines on functional constipation in adults.Neurogastroenterol Motil. 2020;32:e13762
- Andresen V, Banerji V, Hall G et al. : The patient burden of opioid-induced constipation: New insights from a large, multinational survey in five European countries. United European Gastroenterology Journal 2018, Vol. 6(8) 1254–1266
- Lacy BE, Mearin F, Chang L, et al. Bowel Disorders, Gastroenterology 2016;150:1393–1407
- Lewis SJ and Heaton KW. Stool Form Scale as a Useful Guide to Intestinal Transit Time. Scandinavian Journal of Gastroenterology 1997; 32:920–924
Jetzt mehr entdecken
Weitere Informationen über Schmerztherapie für Fachkreise finden Sie hier:
Erhalten Sie Zugang zu vertiefenden Informationen, aktuellen Studien und praxisnahen Materialien rund um das Therapiegebiet Schmerztherapie. Mit Ihrem DocCheck-Login öffnen Sie außerdem den kostenlosen Bestellshop für gedruckte Servicematerialien für Ihre Patienten und Ihre Praxis.
👉 Mit DocCheck einloggen & mehr erfahren
💡 Hinweis: Wählen Sie beim erstmaligen Login bitte die Option „mit Datenübertragung“, damit Ihre Kontaktdaten für die Versandabwicklung unseres kostenlosen Bestellshops zur Verfügung stehen.