Elidel
Gut zu wissen

Bewertung des Schweregrades einer atopischen Dermatitis (AD)
Um die Bewertung des AD-Schweregrades zu standardisieren sind, mehr als 20 verschiedene Bewertungsschemata1 entwickelt worden. Die in klinischen Studien am häufigsten verwendeten Schemata sind der Eczema Area and Severity Index (EASI) sowie der Scoring of Atopic Dermatitis-Index (SCORAD).1-3 Andere häufig angewandte Schweregradskalen in der klinischen Forschung sind eine globale Bewertung durch den Prüfarzt (Investigator’s Global Assessment, IGA) und der Six Area, Six Sign Atopic Dermatitis (SASSAD)-Schweregrad-Score.4-6 Laut einer internationalen Konsensstudie ist der EASI das bevorzugte Tool zur Bewertung klinischer Zeichen einer AD in klinischen Prüfungen.1
Elidel® ist zur Behandlung von Patienten ab 3 Monaten mit leichter bis mittelschwerer atopischer Dermatitis geeignet, bei denen eine Behandlung mit topischen Kortikosteroiden entweder nicht angebracht oder nicht möglich ist, wie z.B. bei: 7
- Unverträglichkeit gegenüber topischen Kortikosteroiden
- mangelnder Wirksamkeit von topischen Kortikosteroiden
- Anwendung im Gesicht und Halsbereich, wo eine intermittierende Langzeitbehandlung mit topischen Kortikosteroiden nicht empfehlenswert ist
Welche Vorteile hat Elidel?
Kurz- und intermittierenden Langzeittherapie7
Verlängert die schubfreien Phasen7
First-Line Therapie für Kinder und sensible Hautareale wie Gesicht und Hals8
Verursacht keine Hautatrophie9
Wiederaufbau der Hautbarriere9
Gut zu wissen!
- Basispflege oder Sonnencreme kann direkt nach der Anwendung von Elidel aufgetragen werden7
- Geeignet für alle Hautareale7
Referenzen:
- Schmitt J, Spuls PI, Thomas KS, et al. The Harmonising Outcome Measures for Eczema (HOME) statement to assess clinical signs of atopic eczema in trials. J Allergy Clin Immunol. 2014;134:800–7.
- Kunz B, Oranje AP, Labreze L, et al. Clinical validation and guidelines for the SCORAD index: consensus report of the European Task Force on Atopic Dermatitis. Dermatology. 1997;195:10–9.
- Hanifin JM, Thurston M, Omoto M, et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis. EASI Evaluator Group. Exp Dermatol. 2001;10:11–8.
- Rehal B, Armstrong AW. Health outcome measures in atopic dermatitis: a systematic review of trends in disease severity and quality-of-life instruments 1985–2010. PLoS One. 2011;6:e17520.
- Sigurgeirsson B, Boznanski A, Todd G, et al. Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial. Pediatrics. 2015;135:597–606.
- Berth-Jones J. Six area, six sign atopic dermatitis (SASSAD) severity score: a simple system for monitoring disease activity in atopic dermatitis. Br J Dermatol. 1996;135 (Suppl 48):25–30.
- Fachinformation ELIDEL®
- Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-82.
- Jensen JM, Pfeiffer S, Witt M, Bräutigam M, Neumann C, Weichenthal M et al. Different effects of pimecrolimus and betamethasone on the skin barrier in patients with atopic dermatitis. J Allergy Clin Immunol. 2009; 123(5):1124-33
Sieben Gründe für eine frühzeitige Behandlung
Pimecrolimus (Elidel®) ist für Dermatologen und Pädiater weltweit der einzige topische Calcineurin-Inhibitor (TCI) mit einer Zulassung zur Behandlung der atopischen Dermatitis (AD) bereits ab einem Alter von 3 Monaten1,2.
Aber das ist nicht der einzige Grund, sich bei der frühen Therapie zur schnellen Kontrolle der AD für Elidel an Stelle eines topischen Corticosteroids (TCS) zu entscheiden – zu den weiteren Gründen, Pimecrolimus bei der Wahl zwischen den beiden einzigen pharmakologischen Rx-Optionen zur frühen AD-Behandlung (TCI oder TCS) zu präferieren, gehören unter anderem, dass Elidel®…
- …den Patienten sehr schnell (ab 24h) zu weniger Juckreiz und besserem Schlaf3,4 verhilft;
- …bei der Behandlung empfindlicher Haut (wie im Gesicht) als S3-Leitlinien-First-line-Option5 eingesetzt werden kann (im Gegensatz zu TCS);
- …genauso gut wirksam ist wie die Anwendung eines niedrig- bis mittelstarken topischen Kortikosteroides6 und von den Patienten besser angenommen wird als TCS7.
- ...zu längerer Schubfreiheit verhelfen kann: bis zu 365 Tage bei Kindern und 144 Tage bei Erwachsenen.1,14,15 Eine Erhaltungstherapie ist nicht notwendig!
Pimecrolimus bietet sich zur frühen, gut wirksamen und verträglichen Behandlung atopischer Dermatitis an – sowohl bei Erwachsenen als auch (und besonders) bei Säuglingen und Kindern, die bereits zu 25 % von AD betroffen sind.6 Der transepidermale Wasserverlust (TEWL) bei Säuglingen ist höher als bei Erwachsenen8, womit die Wiederherstellung der Hautbarriere ein zentraler pathophysiologischer Mechanismus erfolgreicher symptomlindernder Therapie sein sollte.
Verordnen Sie somit frühzeitig Elidel® und verhelfen Sie nicht nur den kleinen AD-Patienten, sondern der gesamten betroffenen Familie durch die schnelle Kontrolle zu mehr Lebensqualität9.
1. Elidel® ist ebenso wirksam wie niedrig- bis mittelpotente topische Corticosteroide (TCS) mit TCS-sparendem Effekt6

Grafik nach Sigurgeirsson B, et al. 2015
2. Sehr schnelle Verbesserungsrate hinsichtlich Pruritus und Schlafqualität der Patienten bei Elidel®4

Grafiken nach Staab D. et al. 2005.
3. Elidel® stellt die Epidermis-Schutzbarriere wieder her und induziert anders als TCS keine Hautatrophie10,11

Bilder von Jensen J.M. et al. 2009
4. Elidel® ist zur Behandlung empfindlicher Haut wie der Gesichtshaut geeignet1

Grafik nach Kempers S. et al. 2004
KOF, Körperoberfläche; ITT, Intent-to-Treat; TAC, Tacrolimus.
Das nicht fettende Produktmerkmal von Pimecrolimus-Creme 1 % wurde von den Patienten eindeutig bevorzugt.12
5. Elidel® ist der einzige TCI, der ab einem Alter von 3 Monaten von der Europäischen Arzneimittelagentur zugelassen wurde1,2

6. Elidel® hat keinen Einfluss auf die Kindheitsparameter6: Entwicklung des Immunsystems, Impfung, Infektionsrate, Wachstumsrate ...
7. Elidel® ist nicht mit einem erhöhten Risiko für Lymphome oder Hautkrebs assoziiert13

AD, atopische Dermatitis; TAC, Tacrolimus; TCI, topische Calcineurin-Inhibitoren; TCS, topische Corticosteroide.
Die Aussage, dass es sich um die einzige von der EMA zugelassene TCI-Behandlung ab einem Alter von 3 Monaten handelt, stammt aus der Fachinformation zu Pimecrolimus und zu Tacrolimus 0,03%.1,2
Referenzen:
1. Elidel® Fachinformation.
2. Protopic® Fachinformation 2021.
3. Kaufmann R. et al. Allergy 2006; 61: 375–381.
4. Staab D. et al. Pediatr Allergy Immunol 2005; 16:527–533.
5. S3-Leitlinie „Atopische Dermatitis“ (AWMF-Registernr. 013-027) (2023)
6. Sigurgeirsson B. et al. Pediatrics 2015; 135(4):597-606.
7. Gollnick H. et al. J Eur Acad Dermatol Venereol 2008; 22:1319-1325.
8. Nikolovski J. et al. Journal of Investigative Dermatology 2008; 128, 1728–1736.
9. Luger T. et al. Pediatr Allergy Immunol. 2021;32:414–424.
10. Jensen J.M. et al. J Allergy Clin Immunol 2009; 123(5):1124-1133.
11. Queille-Roussel C. et al. Br J Dermatol 2001; 144:507-513.
12. Kempers S. et al. J Am Acad Dermatol 2004; 51(4):515–525.
13. Luger T. et al. Pediatric Allergy Immunol 2015; 26:306-315.
14. Wahn U et al: Efficacy and Safety of Pimecrolimus Cream in the Long Term Management of Atopic Dermatitis in Children Pediatrics 2002 Jul;11:e2.
15. Meurer M et al. Dermatology 2002; 205:271–277
Wirkmechanismus
Wirkmechanismus von Calcineurin-Inhibitoren2
Elidel® (Pimecrolimus 1 % Creme), ein Ascomycin Macrolactam Derivat,1 bindet mit hoher Affinität an Macrophilin-12 (auch als FK-bindendes Protein bekannt) und hemmt die Calcineurin Phosphatase.2 Durch die Hemmung der Calcineurin-Funktion blockt Elidel® den normalen T-Zellen-Aktivierungspfad (Abbildung 1).3 Dies wiederum führt zur Inhibierung der T-Zell-Proliferation und der Transkription sowie Freisetzung von proinflammatorischen Zytokinen von T-Zellen, inklusive IL-2, IFN-γ, IL-4 und IL-10.4 Elidel® supprimiert die Freisetzung von Zytokinen sowohl von T-Helfer-1- und T-Helfer-2-Zellen bereits im nanomolaren Konzentrationsbereich, was für die AD relevant ist.2 In höheren Konzentrationen hemmt Elidel® auch die Freisetzung inflammatorischer Zytokine und Mediatoren, inklusive Histamin aus Mastzellen.5
Abbildung 1. Wirkmechanismus von topischen Calcineurin-Hemmern, inklusive Elidel®(Pimecrolimus 1 % Creme)3

FKBP, FK-bindendes Protein (auch Macrophilin-12 genannt); IL, Interleukin; MHC (major histocompatibility complex); NFATc, zytoplasmatische Untereinheit des Nuklearfaktors von aktivierten T-Zellen; NFATn, nukleare Untereinheit des Nuklearfaktors von aktivierten T-Zellen; TNF-α, Tumornekrosefaktor-α
Abbildung nach Nghiem P et al. J Am Acad Dermatol. 2002;46:228-41.
Zellselektivität von Elidel®2
Der Wirkmechanismus von Elidel® ist zellselektiv und zielt hauptsächlich auf T-Zellen ab.2 Elidel® hat keinen Einfluß auf epidermale Langerhans-Zellen (wesentlich für die lokale Immunüberwachung) sowie die Differenzierung und Reifung von dendritischen Zellen.2 Elidel® hat keine Auswirkung auf die Proliferation von Keratinozyten, Endothelzellen oder Fibroblasten.2
Siehe Abbildung 2 zur Übersicht der Selektivität von Elidel® und anderen AD-Behandlungen6-10
Abbildung 2. Wirkmechanismus von Elidel® und anderen AD-Behandlungen 6-10
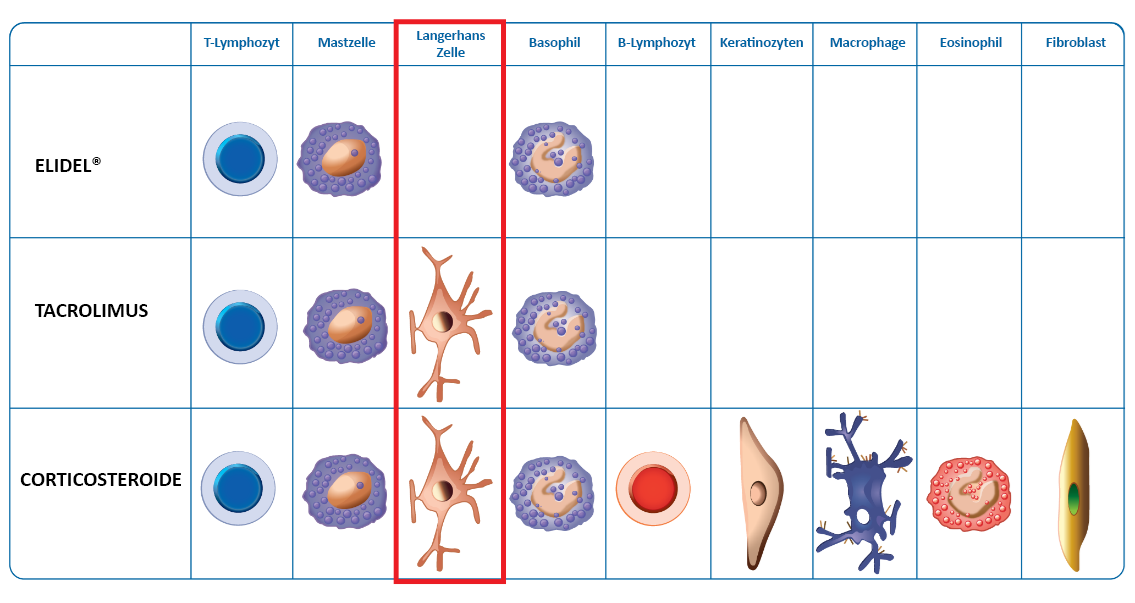
Tabellenausschnitt von: 6. Meingassner JG et al. Br J Dermatol. 2003;149(4):853-857; 7. Grassberger M et al. Exp Dermatol. 2004;13(12):721-730; 8. Cheer SM et al. Am J Clin Dermatol. 2001;2(6):389-406; 9. Meindl S et al. Journal of Investigative Dermatology. 2009;129(9):2184-92; 10. Panhans-Gross A et al. J Allergy Clin Immunol. 2001;107(2):345-52.
Referenzen:
- European Medicines Agency. Pimecrolimus cream 1%: Summary of Product Characteristics. 2019. Available from: https://www.ema.europa.eu/en/documents/referral/elidel-article-31-referral-annex-i-ii-iii_en.pdf. Accessed February 2020.
- Stuetz A, Baumann K, Grassberger M, et al. Discovery of topical calcineurin inhibitors and pharmacological profile of pimecrolimus. Int Arch Allergy Immunol. 2006;141:199–212.
- Nghiem P, Pearson G, Langley RG. Tacrolimus and pimecrolimus: from clever prokaryotes to inhibiting calcineurin and treating atopic dermatitis. J Am Acad Dermatol. 2002;46:228–41.
- Grassberger M, Baumruker T, Enz A, et al. A novel anti-inflammatory drug, SDZ ASM 981, for the treatment of skin diseases: in vitro pharmacology. Br J Dermatol. 1999;141:264–73.
- Zuberbier T, Chong SU, Grunow K, et al. The ascomycin macrolactam pimecrolimus (Elidel®, SDZ ASM 981) is a potent inhibitor of mediator release from human dermal mast cells and peripheral blood basophils. J Allergy Clin Immunol. 2001;108:275–80.
- Meingassner JG, Kowalsky E, Schwendinger H. Pimecrolimus does not affect Langerhans cells in murine epidermis. Br J Dermatol. 2003;149:853-57.
- Grassberger M, Steinhoff M, Schneider D. Pimecrolimus -- an anti-inflammatory drug targeting the skin. Exp Dermatol. 2004;13:721-30.
- Cheer SM, Plosker GL. Tacrolimus ointment. A review of its therapeutic potential as a topical therapy in atopic dermatitis. Am J Clin Dermatol. 2001;2:389-406.
- Meindl S, Vaculik C, Meingassner JG. Differential Effects of Corticosteroids and Pimecrolimus on the Developing Skin Immune System in Humans and Mice. J Invest Dermatol. 2009;129(9):2184–2192.
- Panhans-Groß , Novak N, Kraft S. Human epidermal Langerhans' cells are targets for the immunosuppressive macrolide tacrolimus (FK506). J Allergy Clin Immunol. 2001;107:345-52.
Wirksamkeit
Wussten Sie, dass die Behandlung empfindlicher Haut immer noch eine Herausforderung ist?
- Das Gesicht ist der Bereich, in dem eine Hautempfindlichkeit am häufigsten auftritt1
- 50 % der Patienten mit empfindlicher Haut leiden unter unangenehmen Symptomen wie Juckreiz, brennendes oder stechendes Gefühl, Kribbeln oder Prickeln1
- Richtlinen (in den USA, der EU und Deutschland) bevorzugen die Anwendung topischer Calcineurin-Inhibitoren (TCI) vor topischen Kortikosteroiden (TCS) bei empfindlicher Haut und Elidel® gilt bei Patienten mehr geeignet bei empfindlicher Haut als Tacrolimus 0,03 %2
Wirksamkheit von Elidel® vs. topische Kortikosteroide
Elidel® zeigte in der Langzeit-Behandlung der AD eine gleichwertige Wirksamkeit wie niedrig- bis mittelstarke topische Kortikosteroide im gesamten Körperbereich und Gesicht.5 (Abbildung 1). Dies ist die längste randomisierte Open-Label-Studie, welche topische Kortikosteroid-Behandlungen mit Pimecrolimus vergleicht und bei der 2.439 pädiatrischen Patienten mit milder bis mittelschwerer atopischer Dermatitis eingeschlossen waren.5
Abbildung 1. Langzeitwirksamkeit von Elidel® 1 % Creme im Vergleich zu topischen Kortikosteroiden bei pädiatrischen Patienten mit AD (IGA-Behandlungserfolg Gesicht (IGA ≤1)5

Wirksamkeit von Elidel® vs. Tacrolimus
Eine große Metaanalyse (6413 pädiatrische Patienten) konnte zeigen, dass Elidel® ähnliche Ergebnisse wie Tacrolimus in den Parametern Wirksamkeit und Sicherheit bei der Behandlung einer atopischen Dermatitis bei Kindern erreichte.6
Eine randomisierte Prüfarzt-verblindete Studie zeigte, dass Elidel® für den gesamten Körper genauso wirksam ist wie Tacrolimus 0,03 %, mit einer Tendenz zur besseren Wirksamkeit bei Elidel® im Kopf- und Nackenbereich (Abbildung 1).7
Abbildung 1. Elidel® vs. Tacrolimus 0,03 % bei pädiatrischen Patienten: Reduzierung der von AD betroffenen Fläche am Tag 43.7
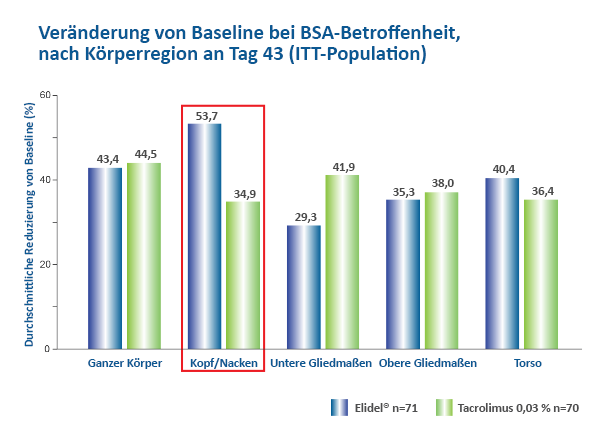
Grafik nach Kempers S et al. J Am Acad Dermatol. 2004;51:515–25.
Erfahren Sie mehr über die bahnbrechende 5-Jahres-Follow-Up-Studie, die Elidel® und topische Kortikosteroide vergleicht, mit Prof. Sigurgeirsson, dem Hauptprüfarzt der Petite-Studie

Allgemeine Wirksamkeit
Bei Patienten mit atopischer Dermatitis führt Elidel® zu einer schnellen Linderung des Pruritus, reduziert das Auftreten von AD-Schüben und reduziert oder eliminiert die Notwendigkeit einer Anwendung von topischen Kortikosteroiden im Vergleich mit einer herkömmlichen Therapie. 8-11
Atopische Dermatitis Pruritus-Linderung 9,10
Zwei multizentrische, randomisierte, doppelblinde, Vehikel-kontrollierte Kurzzeit-Studien untersuchten insbesondere die Wirksamkeit von Elidel® auf den Pruritus bei Erwachsenen, Jugendlichen und Kindern mit leichter bis mittelschwerer AD. 8,9
Beide Studien zeigten, dass Elidel® den Pruritus innerhalb von 48 Stunden verbesserte und dies signifikant schneller im Vergleich zur Vehikelkontrolle.8,9 Bei Erwachsenen betrug die mediane Zeit bis zur Verbesserung des Pruritus 2 Tage bei mit Elidel® behandelten Patienten, im Vergleich zu 4 Tagen bei mit der Kontrolle behandelten Patienten.9 Signifikante Unterschiede zwischen den Gruppen waren innerhalb von 2 Tagen ab Beginn der Behandlung (p=0,003) und innerhalb des gesamten 7-Tage-Behandlungszeitraums offensichtlich (p=0,001) (Abbildung 1).9
Abbildung 1. Zeit bis zur ersten Pruritus-Verbesserung (≥1 Punkt) mit Elidel % Creme vs. Vehikel bei Erwachsenen mit AD9

Reduzierung der atopischen Dermatitis-Schübe und Notwendigkeit eines topischen Kortikosteroids10-14
Die Effekte von Elidel® bei der Behandlung von AD-Schüben und der Notwendigkeit von topischen Kortikosteroiden wurde in einer Reihe von großen, Langzeit (6 oder 12 Monate), multizentrischen, randomisierten, doppelblinden, vehikelkontrollierten Studien untersucht.10,11,12
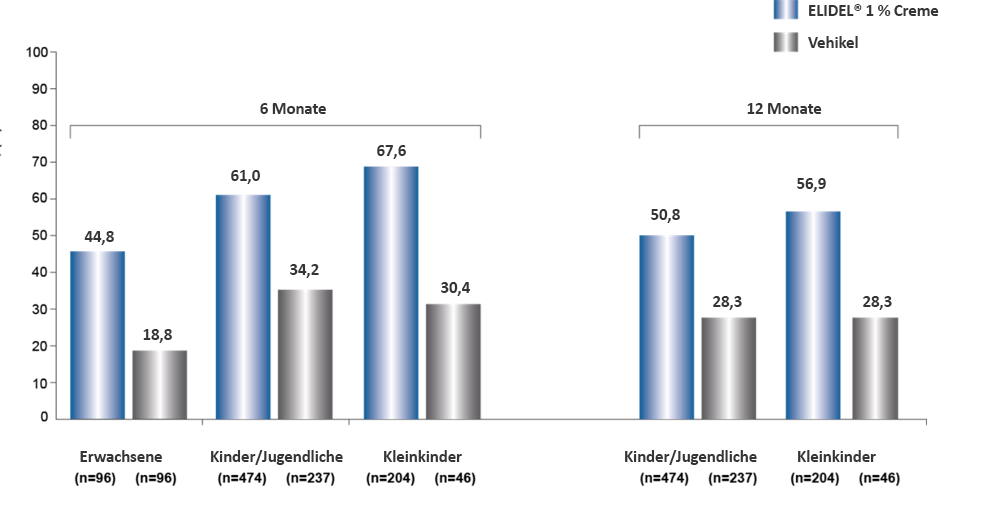
In diesen Studien war Elidel® mit signifikant weniger AD-Schüben assoziiert als das Vehikel (d. h. herkömmliche Behandlung) bei Kleinkindern, Kindern/Jugendlichen und Erwachsenen (p<0,001 in allen Studien).10,11,12 Zudem war der Anteil der Patienten, die nach 6 Monaten keine AD-Schübe erlitten, zweimal höher mit Elidel® im Vergleich mit dem Vehikel in allen Studien (Abbildung 2).10,11,120Diese Vorteile konnten in zwei weiteren Studien mit einem längeren Follow-up nach 12 Monaten bestätigt werden (Abbildung 2).10,11
Abbildung 2. Effekte von Elidel® 1 % Creme auf AD-Schüben10,11,12
Die Wirksamkeit von Elidel® als Präventionsstrategie für AD-Schübe wurde in zwei 6-Monats-, multizentrischen, doppelblinden, randomisierten, vehikelkontrollierten Studien bei Kindern/Jugendlichen und Erwachsenen untersucht.13,14
In beiden Studien reduzierte Elidel® signifikant die Anzahl der AD-Schübe im Vergleich zum Vehikel.6,7 Erwachsene, die mit Elidel® behandelt wurden, litten unter 61 % weniger Schüben, die eine Behandlung mit topischen Kortikosteroiden erforderten, als Patienten, die das Vehikel erhielten (Median jeweils 0,39 vs. 1,00; p=0,0014),6 Kinder und Jugendliche litten unter 50 % weniger Schüben, die ein TCS erforderlich machten, wenn sie mit Elidel® und nicht dem Vehikel behandelt wurden (Durchschnitt je 0,84 vs. 1,68; p<0,0001).7 In beiden Studien waren mit Elidel® behandelte Patienten signifikant länger schubfrei, als die mit Vehikel behandelte Patienten (Erwachsene: Median jeweils >190 Tage vs. 67 Tage; p<0,001; Kinder/Jugendliche: Median jeweils >190 Tage vs. 59 Tage; p<0,0001) (Abbildung 3).6,7
Abbildung 3. Prozentsatz der Patienten ohne AD-Schub mit ELIDEL® 1 % Creme vs. Vehikel bei Erwachsenen6 und (B) Jugendlichen und Kindern7
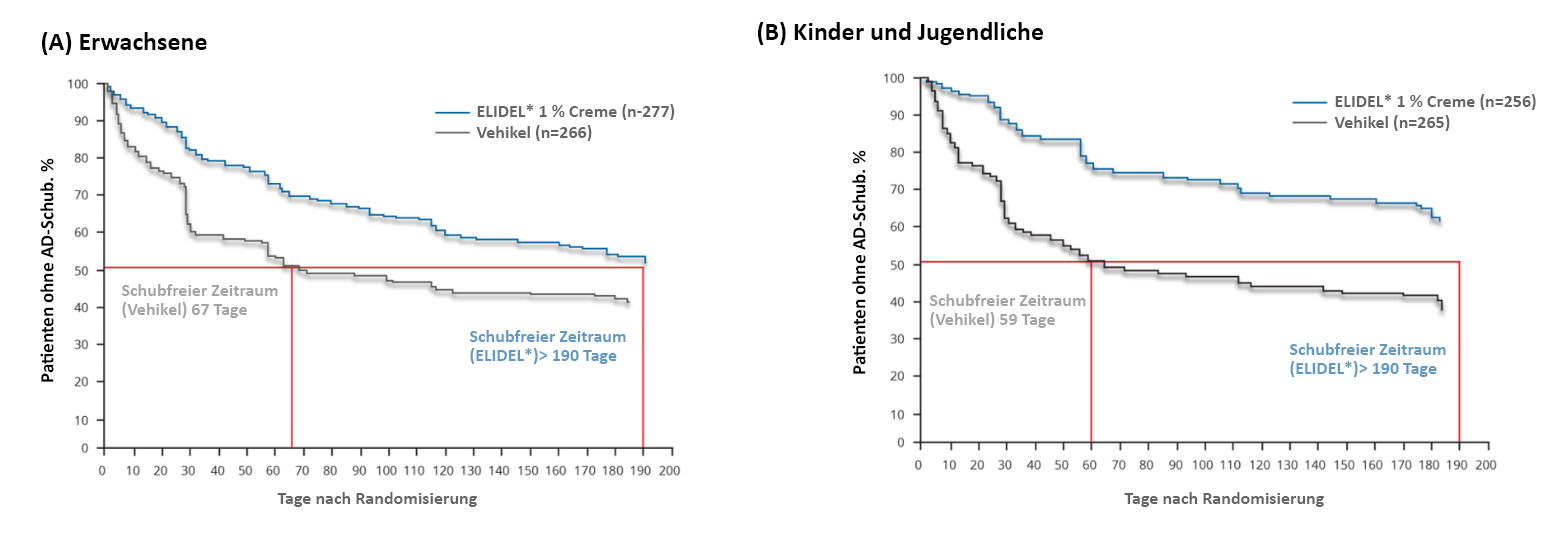
Abbildung nach Gollnick H et al. Br J Dermatol. 2008;158:1083-93 and Sigurgeirsson B et al. J Eur Acad Dermatol Venereol. 2008;22:1290-301.
Wirksamkeit bei empfindlichen Hautbereichen8
Elidel® ist auch bei empfindlicher Haut wirksam. In einer 6-monatigen, offenen, multizentrischen Studie mit 947 Patienten im Alter ab 3 Monaten mit atopischer Dermatitis, bei denen eine Anwendung von topischen Kortikosteroiden nicht empfohlen war, war eine Verbesserung mit Elidel® nachweisbar im Gesicht unabhängig von Alter (Abbildung 4)8
Abbildung 4. Anteil der Patienten, die in Woche 24 keine oder nur kaum Anzeichen einer atopischen Dermatitis aufwiesen (Investigator’s Global Assessment (IGA) mit Score 0 oder 1) nach Schweregrad der Erkrankung bei Baseline und Altersgruppe im Gesicht8

Grafik nach Lübbe J et al. Am J Clin Dermatol. 2006;7(2):121-131.
Referenzen:
- Berardesca E, Farage M, Maibach H. Sensitive skin: an overview. Int J Cosmet Sci. 2013;35(1):2-8.
- Reda AM, Elgendi, E, Aldraibi MS, et al. A practical algorithm for topical treatment of atopic dermatitis in the Middle East emphasizing the importance of sensitive skin areas. J Dermatolog Treat. 2019;30(4):366-73.
- Wollenberg A, Barbarot S, Bieber T, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-82.
- Aubert-Wastiaux H, Moret L, Le Rhun A, et al. Topical corticosteroid phobia in atopic dermatitis: a study of its nature, origins and frequency. Br J Dermatol. 2011;165:808-14.
- Sigurgeirsson B, Boznanski A, Todd G, et al. Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial. Pediatrics. 2015;135:597–606.
- Huang X, Xu B. Efficacy and Safety of Tacrolimus versus Pimecrolimus for the Treatment of Atopic Dermatitis in Children: A Network Meta-Analysis. Dermatology (Basel). 2015;231(1):41-9.
- Kempers S, Boguniewicz M, Carter E, et al. A randomized investigator-blinded study comparing pimecrolimus cream 1% with tacrolimus ointment 0.03% in the treatment of pediatric patients with moderate atopic dermatitis. J Am Acad Dermatol. 2004;51:515–25.
- Fowler J, Johnson A, Chen M, et al. Improvement in pruritus in children with atopic dermatitis using pimecrolimus cream 1%. Cutis. 2007;79:65–72.
- Kaufmann R, Bieber T, Helgesen AL, et al. Onset of pruritus relief with pimecrolimus cream 1% in adult patients with atopic dermatitis: a randomized trial. Allergy. 2006;61:375–81.
- Meurer M, Folster-Holst R, Wozel G, et al. Pimecrolimus cream in the long-term management of atopic dermatitis in adults: a six-month study. Dermatology. 2002;205:271–7.
- Kapp A, Papp K, Bingham A, et al. Long-term management of atopic dermatitis in infants with topical pimecrolimus, a nonsteroid anti-inflammatory drug. J Allergy Clin Immunol. 2002;110:277–84.
- Wahn U, Bos JD, Goodfield M, et al. Efficacy and safety of pimecrolimus cream in the long-term management of atopic dermatitis in children. Pediatrics. 2002;110:e2.
- Gollnick H, Kaufmann R, Stough D, et al. Pimecrolimus cream 1% in the long-term management of adult atopic dermatitis: prevention of flare progression. A randomized controlled trial. Br J Dermatol. 2008;158:1083–93.
- Sigurgeirsson B, Ho V, Ferrandiz C, et al. Effectiveness and safety of a prevention-of-flare-progression strategy with pimecrolimus cream 1% in the management of paediatric atopic dermatitis. J Eur Acad Dermatol Venereol. 2008;22:1290–301.
- Lübbe J, Friedlander SF, Cribier B, et al. Am J Clin Dermatol. 2006;7(2):121-131.
Sicherheit und Verträglichkeit

Tabelle 1. Vergleich von Brenngefühl an der Anwendungsstelle1-3
Außerdem sind die Reaktionen an der Anwendungsstelle bei Elidel® von kürzerer Dauer im Vergleich zu Tacrolimus 0,03 %.4 Die maximale Dauer dieser Reaktionen an der Anwendungsstelle (Application-Site Reactions, ASRs) bei mit Elidel® behandelten Kindern beträgt 30 Minuten, während 23,1% der mit Tracrolimus 0,03 % behandelten Kindern unter Erythemen oder irritierenden Reaktionen litt, die mehr als 12 Stunden andauerten (Abbildung 1).4

Abbildung 1. Dauer des Erythems oder irritierenden Reaktionen bei Patienten, die an Tag 4 der Behandlung von ASR berichteten (rechts)4
Abbildung nach Kempers S et al. J Am Acad Dermatol. 2004;51:515–25.
Erfahren Sie mehr darüber, was Patienten über Elidel® im Vergleich zu Tacrolismus 0,03 % denken
In einer prospektiven, multizentrischen, randomisierten, Prüfarzt-verblindeten Studie erhielten Kinder und Jugendliche mit mittelschwerer AD Elidel® 1 % Creme (n=71) oder Tacrolimus-Salbe 0,03 % (n=70). 4 Die Formulierung von Elidel® wurde von Patienten oder Betreuenden als signifikant besser im Vergleich zu Tacrolimus für die Behandlung von empfindlicher Gesichtshaut (p=0,009), nicht-klebriges Gefühl (p<0,001), einfache Anwendung (p=0,02), einfaches Einreiben (0,015) und öliges Gefühl auf der Haut (p<0,001) an Tag 43 bewertet (Abbildung 1). 4

Abbildung 2. Antworten auf den Akzeptanzfragebogen (Produktmerkmale) an Tag 434
Abbildung nach Kempers S, et al. J Am Acad Dermatol. 2004;51:515–25.
- Das nicht-fettende Produktmerkmal von Elidel® wurde von den Patienten klar bevorzugt im Vergleich zu einer TAC 0,03% Salbe
- Patienten fanden Elidel® geeigneter für das Gesicht4.
Erfahren Sie mehr darüber, was Patienten von Elidel® im Vergleich zu topischen Kortikosteroiden halten
Die multizentrische Beobachtungsstudie zeigte Patienten mit leichter bis mittelschwerer AD, die eine topischen Kortikosteroid Behandlung erhielten, gefolgt von einer intermittierenden Behandlung mit Elidel®.5 Die Zufriedenheit von Patienten und Betreuenden war konsistent höher bei Elidel® bei Fragen zur Linderung von Symptomen, Einfachheit der Anwendung, Lebensqualität und Schlafqualität vs. TCS durch retrospektive Vergleiche (Abbildung 1).5
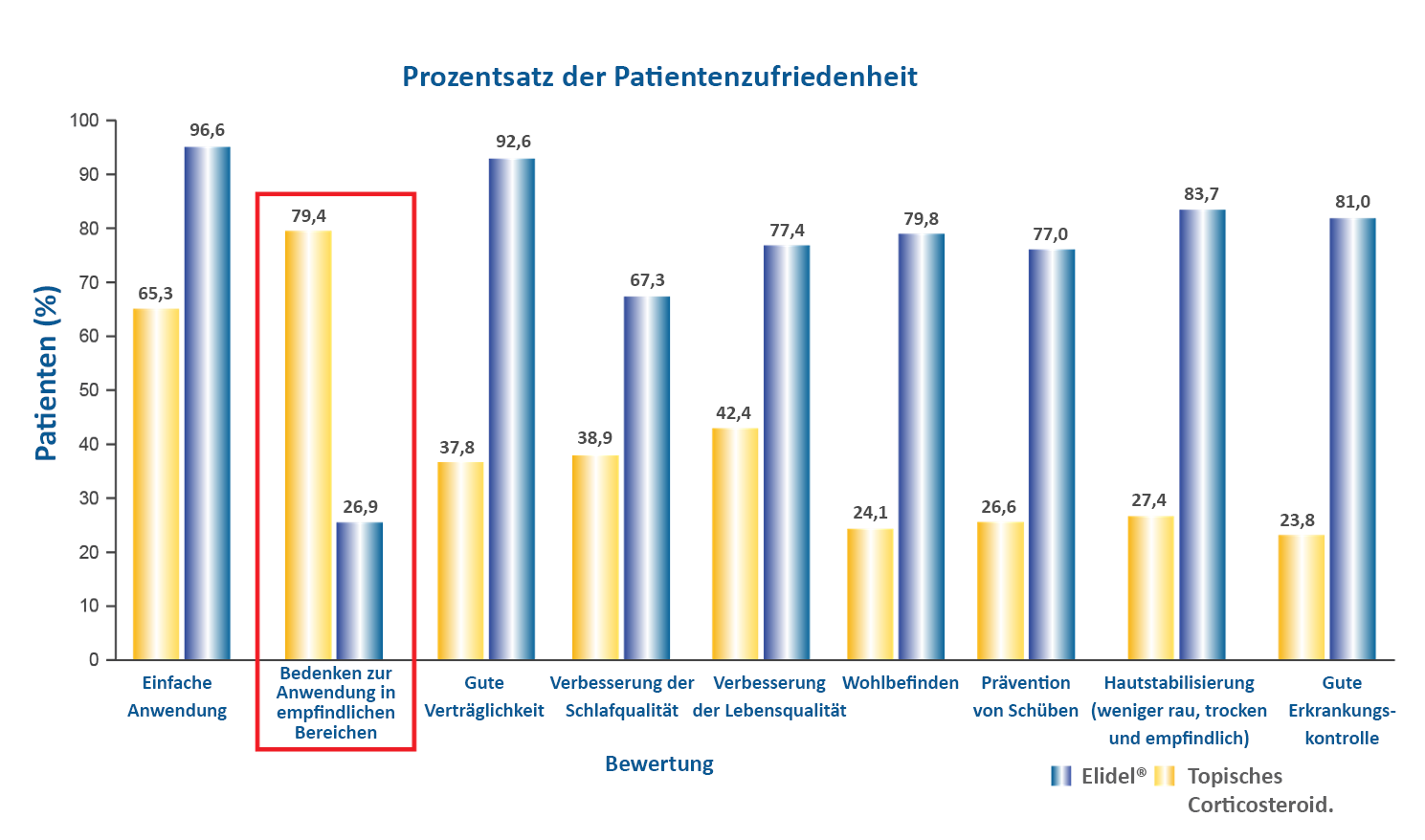
Abbildung 3. Prozentsatz der Patientenzufriedenheit5
Abbildung nach Gollnick H et al. J Eur Acad Dermatol Venereol. 2008;22:1319–25.
-Bei 79,4 % der Patienten (gepoolte Daten von „volle Zustimmung“ und „Zustimmung“) bestehen Bedenken bei der Anwendung von topischen Kortikosteroiden bei empfindlicher Haut5
-Fast 84 % der Patienten stimmen zu, dass Elidel® die Haut stabilisiert, im Vergleich zu weniger als 30 % der mit topischen Kortikosteroiden behandelten Patienten.5
- Fast 93 % der Patienten stimmten zu, dass Elidel® gut verträglich ist im Vergleich mit weniger als 40 % der mit topischen Kortikosteroiden behandelten Patienten.5
Nimmt Elidel® Einfluss auf ein sich entwickelndes Immunsystem?
Die immunologischen Untersuchungen in der Petite-Studie stellen die umfangreichsten Bewertungen dar, die jemals durchgeführt wurden, und analysierten den Einfluss realer Behandlungen einer atopischen Dermatitis auf die Ausreifung des Immunsystems in einer großen internationalen Population von Kleinkindern mit atopischer Dermatitis in den ersten 5 bis 6 Lebensjahren.6 Der Anstieg der Ig-Werte and das Abnehmen der zirkulierenden T- und B-Lymphozyten war in beiden Gruppen, Elidel® und topische Kortikosteroide ähnlich und entsprach der normalen Heranreifung des systemischen Immunsystems bei gesunden Kindern (Abbildung 1). 6
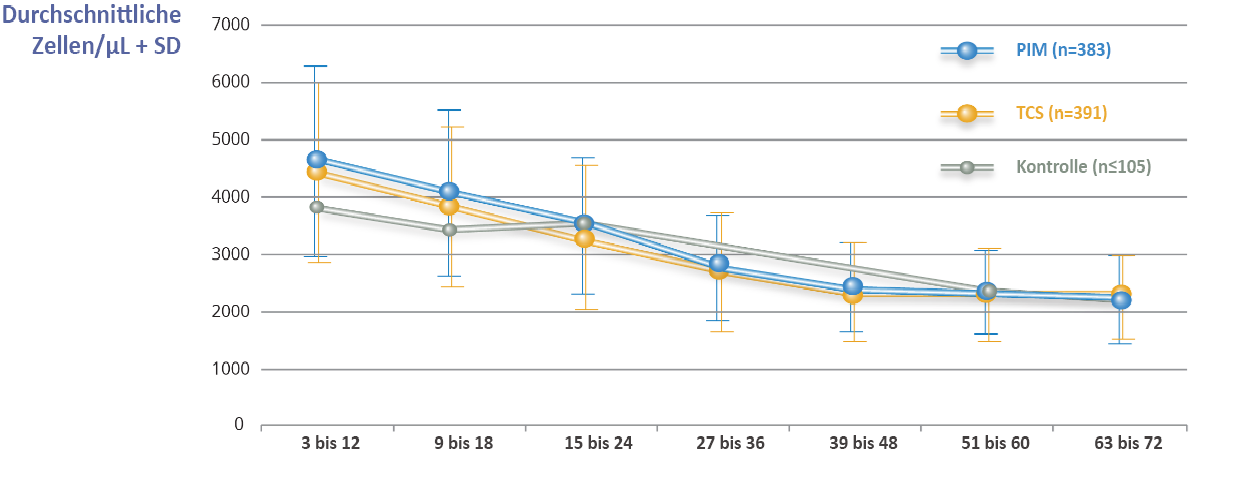
Abbildung 4. Evolution der CD3+-Zellwerte 1
Abbildung nach Sigurgeirsson B, et al. Pediatrics 2015;135:597-606. (Grafik aus Abbildung 7 in ergänzenden Informationen SI1-SI7)
Allgemeines Verträglichkeitsprofil von Elidel®
Hautatrophie und Beeinträchtigung der epidermalen Barriere
Die Effekte von Elidel® 1 % Creme vs. topische Kortikosteroide auf die Haut wurden in drei Within-Subject-
Vergleichsstudien bei gesunden Freiwilligen7 und Patienten mit AD untersucht. 8.9
In einer randomisierten, doppelblinden, Within-Subject-Studie und gesunden Freiwilligen wurde an Tag 29 beobachtet, dass die relative Veränderung der gesamten Hautdicke mit Elidel sich nicht signifikant vom Vehikel unterscheidet, während es bei beiden genutzten topischen Kortikosteroiden in der gesamten Studie zu einer progressiven Abnahme der Hautdicke kam. Der Unterschied in der Hautdicke zwischen mit Elidel® behandelten Patienten und den Patienten, die eines der beiden topischen Kortikosteroide erhielten, war ab Tag 8 signifikant.7 Eine histologische Analyse an Tag 29 zeigte eine signifikante epidermale Verdünnung mit topischen Kortikosteroiden im Vergleich zu Elidel® (p<0,001 vs. Betamethason-valerat oder Triamcinolonacetonid).7 (Abbildung 1)

Abbildung 5. Durchschnittliche relative prozentuale Veränderung der gesamten Hautdicke7
Abbildung nach Queille-Roussel C et al. Br J Dermatol. 2001;144(3):507-513.
In einer weiteren Studie wurde sogar gezeigt, dass Elidel® eine von topischen Kortikosteroiden induzierte Atrophie bei 46,5 % der Patienten umkehrte*10 (Abbildung 2)

Abbildung 6. Veränderungen von Baseline am Ende des 6-wöchigen, doppelblinden Zeitraums bei Patienten mit Hautatrophie nach Anwendung eines topischen Kortikosteroids4
* Patienten mit Hautatrophie bei Baseline aufgrund einer TCS Anwendung
TCS: topische Kortikosteroide; Abbildung nach Murrell DF et al. Br J Dermatol 2007; 157(5):954-959
In einer randomisierten Studie wurden 15 AD-Patienten 3 Wochen lang auf einem Arm zweimal täglich mit Pimecrolimus behandelt und auf dem anderen Arm mit Betamethason. Elidel® und Betamethasonvalerat reduzierten nach 3 Behandlungswochen signifikant die Hautproliferation (jeweils p=0,08 und p<0,05), was zu einer signifikanten Reduzierung der Epidermisdicke bei beiden Wirkstoffen führt (Elidel®, 49 %; Betamethason-valerat, 74 %; p<0,05 in beiden Gruppen); allerdings lag der Wert in der Elidel®-Gruppe im Rahmen für gesunde Haut. 3 Elidel® verbesserte auch mehrere Integritätsmarker der Hautbarriere (Hydratation des Stratum corneums, transepidermaler Wasserverlust und Farbeindringung) und normalisierte die Epidermisdifferenzierung nach 3 Behandlungswochen.9 (Abbildung 3)
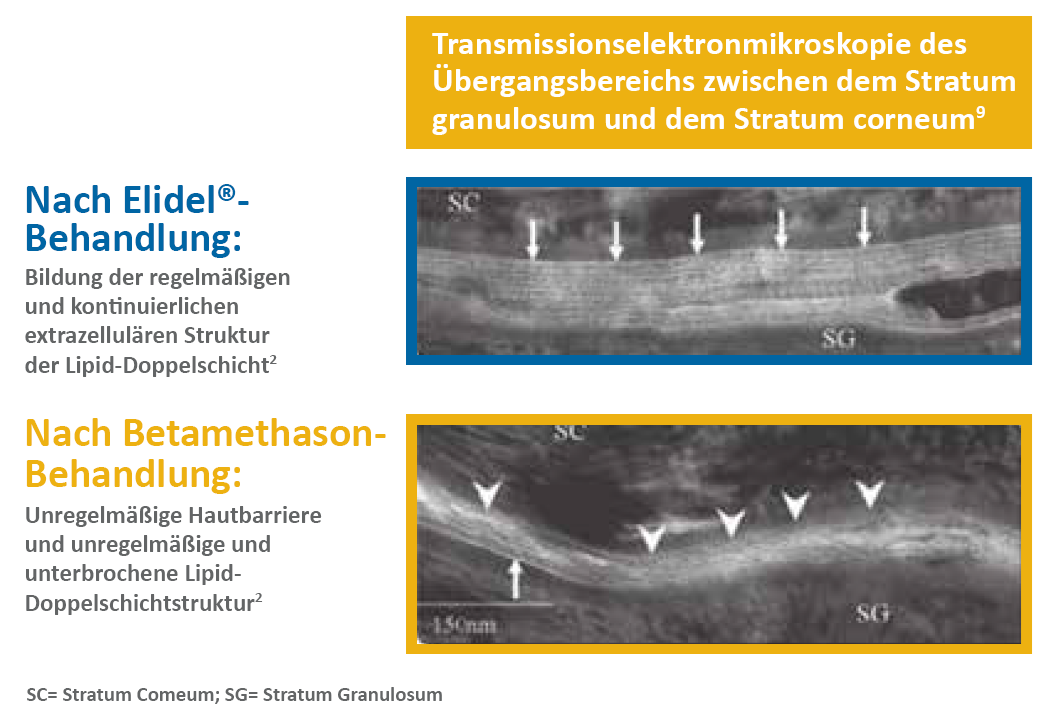
Abbildung 7. Effekte nach der Behandlung auf die Struktur nach der Hautbarriere3
Abbildung nach Jensen JM et al .J Allergy Clin Immunol. 2009;124:R19–28.
Reaktionen an der Anwendungsstelle mit Elidel
Die am häufigsten gemeldeten unerwünschten Ereignisse waren ein brennendes Gefühl an der Anwendungsstelle, berichtet bei 1–11 % von Kindern, Jugendlichen und Erwachsenen in verschiedenen Studien.11–15 Das Brenngefühl an der Anwendungsstelle trat vorübergehend auf und war meist nur leicht bis mittelschwer.12-15 In einer gepoolten Analyse wurde festgestellt, dass Reaktionen an der Anwendungsstelle bei <1% der mit Elidel® behandelten Kleinkinder auftraten.16
Das vorübergehende Wärme-, Juck- oder Brenngefühl an der Anwendungsstelle trat während der ersten Anwendungstage häufiger mit der Tacrolimus-Salbe auf als mit der Pimecrolimus-Creme und wenn diese Medikamente auf akut entzündete Haut aufgetragen wurden.17
Permeabilität durch menschliche Haut
Die Durchdringung durch die menschliche Haut war bei Elidel® im Vergleich zu topischen Kortikosteroiden um einen Faktor 70-110 geringer,18 bei Pimecrolimus im Vergelichzu Tacrolimus 0,1 % um einen Faktor von 9-10 geringer.18
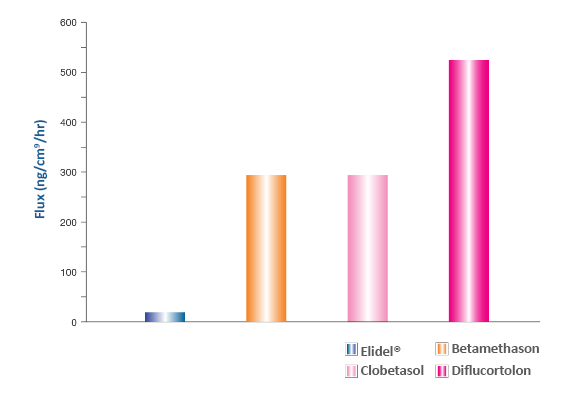
Abbildung 8. Hautpermeabilität von Pimecrolimus, Betamethason-17-valerat, Clobetasol-17-propionat, Diflucortolon-21-valerat18
Abbildung nach Billich A, et al. Int J Pharm. 2004;269(1):29-35.

Abbildung 9. Hautpermeabilität von Pimecroliums und Tacrolimus 0,1 %18
Abbildung nach Billich A, et al. Int J Pharm. 2004;269(1):29-35.
Risiko eines Lymphoms oder von Hautkrebs
![]()
Klinische Studien zu Elidel® bei Kleinkindern zeigten auch, dass Elidel® das sich entwickelnde Immunsystem nicht beeinträchtigen.16
![]()
In der 5-Jahres Petite-Studie wurden keine Fälle eines T-Zell-Lymphoms oder von Hautmalignitäten bei Elidel® gemeldet.6
![]()
Diese Ergebnisse werden von 5 epidemiologischen Studien unterstützt, an denen mehr als 6,5 Millionen Patienten mit AD teilnahmen, die keine Nachweise dafür lieferten, dass es ein vermehrtes Lymphomrisiko mit Elidel® gibt.16
Referenzen:
- Lynde C, Barber K, Claveau J. Canadian practical guide for the treatment and management of atopic dermatitis. J Cutan Med Surg. 2005;8 Suppl 5:1-9.
- Reitamo S, Wollenberg A, Schöpf E. Safety and Efficacy of 1 Year of Tacrolimus Ointment Monotherapy in Adults With Atopic Dermatitis Arch Dermatol. 2000;136(8).999-1006.
- Ring J, Abraham A, de Cuyper C. Control of atopic eczema with pimecrolimus cream 1% under daily practice conditions: results of a > 2000 patient study. J Eur Acad Dermatol Venereol. 2008;22(2):195-203.
- Kempers S, Boguniewicz M, Carter E, et al. A randomized investigator-blinded study comparing pimecrolimus cream 1% with tacrolimus ointment 0.03% in the treatment of pediatric patients with moderate atopic dermatitis. J Am Acad Dermatol. 2004;51:515–25.
- Gollnick H, Luger T, Freytag S, Brautigam M, STABIEL study group. StabiEL: stabilization of skin condition with Elidel –a patients' satisfaction observational study addressing the treatment, with pimecrolimus cream, of atopic dermatitis pretreated with topical corticosteroid. J Eur Acad Dermatol Venereol. 2008;22:1319–25.
- Sigurgeirsson B, Boznanski A, Todd G, et al. Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial. Pediatrics. 2015;135(4):597-606.
- Queille-Roussel C, Paul C, Duteil L, et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study. Br J Dermatol. 2001;144:507–13.
- Aschoff R, Schmitt J, Knuschke P, et al. Evaluation of the atrophogenic potential of hydrocortisone 1% cream and pimecrolimus 1% cream in uninvolved forehead skin of patients with atopic dermatitis using optical coherence tomography. Exp Dermatol. 2011;20:832–6.
- Jensen JM, Pfeiffer S, Witt M, et al. Different effects of pimecrolimus and betamethasone on the skin barrier in patients with atopic dermatitis. J Allergy Clin Immunol. 2009;124:R19–28.
- Murrell DF, Calvieri S, Ortonne JP, et al. A randomized controlled trial of pimecrolimus cream 1% in adolescents and adults with head and neck atopic dermatitis and intolerant of, or dependent on, topical corticosteroids. Br J Dermatol. 2007;157:954–9.
- Fowler J, Johnson A, Chen M, et al. Improvement in pruritus in children with atopic dermatitis using pimecrolimus cream 1%. Cutis. 2007;79:65–72.
- Wahn U, Bos JD, Goodfield M, et al. Efficacy and safety of pimecrolimus cream in the long-term management of atopic dermatitis in children. Pediatrics. 2002;110:e2.
- Gollnick H, Kaufmann R, Stough D, et al. Pimecrolimus cream 1% in the long-term management of adult atopic dermatitis: prevention of flare progression. A randomized controlled trial. Br J Dermatol. 2008;158:1083–93.
- Sigurgeirsson B, Ho V, Ferrandiz C, et al. Effectiveness and safety of a prevention-of-flare-progression strategy with pimecrolimus cream 1% in the management of paediatric atopic dermatitis. J Eur Acad Dermatol Venereol. 2008;22:1290–301.
- Eichenfield LF, Lucky AW, Boguniewicz M, et al. Safety and efficacy of pimecrolimus (ASM 981) cream 1% in the treatment of mild and moderate atopic dermatitis in children and adolescents. J Am Acad Dermatol 2002;46:495–504.
- Luger T, Boguniewicz M, Carr W, et al. Pimecrolimus in atopic dermatitis: consensus on safety and the need to allow use in infants. Pediatr Allergy Immunol. 2015;26:306–15.
- Wollenberg A, Barbarot S, Bieber T, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-82.
- Billich A, Aschauer H, Aszódi A, et al. Percutaneous absorption of drugs used in atopic eczema: pimecrolimus permeates less through skin than corticosteroids and tacrolimus. Int J Pharm. 2004;269(1):29-35.
Leitlinien
Neue deutsche S3-Leitlinie bestätigt topische Calcineurin-Inhibitoren als First-Line Therapie1**
Die im Juli dieses Jahres publizierte deutsche S3-Leitlinie zur atopischen Dermatitis (AD) empfiehlt Calcineurin-Inhibitoren (TCI) wie Pimecrolimus als First-Line Therapie bei Unverträglichkeit und Nichtwirksamkeit von topischen Glukokortikosteroiden (TCS) und für empfindliche Hautbereiche.1**
Die aktualisierte S3-Leitlinie in Deutschland basiert auf den jährlich aktualisierten europäischen Leitlinien2, deren methodischen Arbeit dem S3 Status entspricht. Die deutsche AD-Leitlinie wurde somit von einem S2K- auf einen S3-Status angehoben. Die S3-Leitlinie deckt alle aktuell zugelassenen Systemtherapeutika ab und unterstützt bei der Bewertung individueller Diagnostik. Der hohe Stellenwert der topischen Therapie bestehend aus Basistherapie, antientzündlicher und antimikrobieller Therapie wird umfassend diskutiert und bewertet.
Die Autorengruppe hat aus Gründen der Übersichtlichkeit nicht alle Verfahren, die in der S3-Leitlinie diskutiert werden, in folgendem Stufenschema abgebildet:
Deutsche S3-Leitlinie:1 Stufenschema zur Therapie der atopischen Dermatitis (AD)
* Eine UV-Therapie kann ab Stufe 3, insbesondere im Erwachsenenalter, indiziert sein. Cave: keine Kombination von UV-Therapie mit Ciclosporin oder topischen Calcineurininhibitoren (TCI)
** First-line Therapie: In der Regel topische Glukokortikosteroide (TCS), bei Unverträglichkeit/Nichtwirksamkeit und an besonderen Lokalisationen (z. B. Gesicht, intertriginöse Hautareale, Anogenitalbereicht) topische Calcineurininhibitoren
*** Die zusätzliche Anwendung von antipruriginösen und antiseptischen Wirkstoffen kann erwogen werden.
Abbildung modifiziert nach S3-Leitlinie „Atopische Dermatitis“ (AWMF-Registernr. 013-027) (2023)
Als topische antientzündliche Therapien sind aktuell in Europa Glukokortikosteroide (TCS) und Calcineurininhibitoren (TCI) zugelassen. Im Folgenden aufgeführt die Empfehlungen der S3-Leitlinie für die antientzündliche Therapie1:
Empfehlungen für die antientzündliche Therapie
Abbildung modifiziert nach S3-Leitlinie „Atopische Dermatitis“ (AWMF-Registernr. 013-027) (2023)
Die Leitlinie finden Sie hier bei AWMF.org
Kurzbroschüre zur S3-Leitlinie atopische Dermatitis

6-seitige Übersicht zur neuen deutschen S3-Leitlinie atopische Dermatitis, mit allen wichtigen Therapie- und Anwendungsempfehlungen für die Praxis
Hier PDF herunterladen
Leitlinien-Empfehlung Dermatologie mit Kasuistik von Prof. Thomas Werfel

In der zweiseitigen Empfehlung zur Behandlung der atopischen Dermatitis geht Prof. Thomas Werfel auf einen Fallbericht einer 35-jährigen Patientin ein.
Hier PDF herunterladen
Leitlinien-Empfehlung Pädiatrie mit Kasuistik von Prof. Eckard Hamelmann

In der zweiseitigen Empfehlung zur Behandlung der atopischen Dermatitis geht Prof. Hamelmann auf einen Fallbericht eines 7 Monate alten Säuglings ein.
Hier PDF herunterladen
Weltweit in Leitlinien empfohlen – Pimecrolimus bei AD von sensibler Haut
Aufgrund der breit aufgestellten Datenlage und dem günstigen Sicherheitsprofil wird Pimecrolimus in mehr als 50 Ländern eingesetzt3 und weltweit in Leitlinien zur Therapie der AD empfohlen. Im Folgenden finden Sie eine Auswahl internationaler Leitlinien zur AD-Behandlung. Wie in der deutschen S3-Leitlinie wird Pimecrolimus für die Behandlung von empfindlichen Hautbereichen und auch besonders bei Kindern empfohlen:
Asien-Pazifik4
- Das Expertenpanel zu atopischer Dermatitis der Asian Academy of Dermatology and Venereology (Asiatische Akademie der Dermatologie und Venereologie) entwickelte diesen Referenzleitfaden, um einen holistischen und evidenzbasierten Ansatz zur Behandlung von AD bei Asiaten bereitzustellen.
- Die Empfehlungen wurden auf Basis der Richtlinien des britischen National Institute for Health and Care Excellence und des schottischen Intercollegiate Guidelines Network bewertet.
Südafrika5
- Ein Gremium aus 12 Experten für AD erarbeitete einen praktischen Algorithmus für das Management im klinischen Alltag und Praxis für Kinder und Jugendliche
- Empfehlung von Pimecrolimus in der (Langzeit-)Anwendung, First-Line in sensiblen Arealen, auch < 2 Jahren
International6
- Ein internationales Panel von Dermatologie- und Allergieexperten aus China, Deutschland, Russland, der Türkei, Ukraine, Belarus, Jordanien und den Vereinigten Arabischen Emiraten verfasste ein Konsens-Dokument namens „Practical algorithm to inform clinical decision-making in the topical treatment of atopic dermatitis“ (Praktischer Algorithmus zur Entscheidungsfindung bei der topischen Behandlung von atopischer Dermatitis).
- Dieser Behandlungsalgorithmus kann bei der klinischen Entscheidungsfindung helfen und womöglich zu einer Entlastung der AD für den Patienten, ihrer Familien und der Gesundheitssysteme führen.
- Empfehlung bei leichter bis mittelschwerer AD:
- Pimecrolimus 1 % als bevorzugter topischer Calcineurininhibitor (TCI) zur Anwendung in empfindlichen Hautbereichen aufgrund des Wirksamkeits-, Verträglichkeits- und Selektivitätsprofils im Vergleich zu Tacrolimus.*
- Pimecrolimus und Tacrolimus werden für verschiedene Körperbereiche empfohlen.
- Topische Glukokortikosteroide (TCS) werden nur für die kurzzeitige Anwendung in Fällen schwerer Schübe empfohlen aufgrund ihrer Nebenwirkungen, wie die Verdünnung der Epidermisbarriere.

AD: Atopische Dermatitis; TCS: Topische Corticosteroide, TCI: Topische Calcineurin-Inhibitoren
Abbildung modifiziert nach: Luger T, et al. J Dermatol. 2021;00:1–10. DOI: 10.1111/1346-8138.15921
aDiese Bereiche umfassen den Kopf, das Gesicht (Augenlider und perioraler Bereich), Nacken, Axilla-Region, inguinale Falten und Genitalbereich. In diesen Bereichen wird eine Creme im Vergleich zu einer Salbe bevorzugt.
bPimecrolimus 1 % Creme bei Patienten ab 3 Monaten und älter, Tacrolimus 0,1 % Salbe bei Erwachsenen; Tacrolimus 0,03 % Salbe für Kinder. Pimecrolimus ist indiziert für leichte bis mittelschwere AD und Tacrolimus ist indiziert für mittelschwere bis schwere AD.
*Pimecrolimus ist indiziert für die Behandlung von leichter oder mittelschwerer atopischer Dermatitis für Erwachsene und Kinder, bei denen die Behandlung mit topischen Kortikosteroiden entweder nicht zu empfehlen oder nicht möglich ist. Pimecrolimus ist zweimal täglich auf die betroffenen Bereiche aufzutragen, bis die Anzeichen und Symptome der AD abgeklungen sind.
Pimecrolimus sollte so kurz wie möglich während eines Erkrankungsschubes angewendet werden. Die Behandlung sollte periodisch, kurzzeitig und nicht kontinuierlich sein.
Klinische Praxis: Wie kann eine steroidfreie Behandlung der atopischen Dermatitis optimiert werden? Tipps von Prof. Luger

* Elidel ist zugelassen für die Behandlung von Patienten ab einem Alter von 3 Monaten mit leichtem oder mittelschwerem atopischem Ekzem, wenn eine Behandlung mit topischen Kortikosteroiden entweder nicht angebracht oder nicht möglich ist, wie z. B. bei: Unverträglichkeit gegenüber topischen Kortikosteroiden; mangelnder Wirksamkeit von topischen Kortikosteroiden; Anwendung im Gesicht und Halsbereich, wo eine intermittierende Langzeitbehandlung mit topischen Kortikosteroiden nicht empfehlenswert ist.
Referenzen:
- S3-Leitlinie „Atopische Dermatitis“ (AWMF-Registernr. 013-027) (2023)
- Wollenberg, A et al. European guideline (EuroGuiDerm) on atopic eczema – part II: non-systemic treatments and treatment recommendations for special AE patient populations. J Eur Acad Dermatol Venereol. 2022 Nov;36(11):1904-1926.
- Mylan Pharmaceutical Pvt. Ltd. Data on File - IQVIA MIDAS Quarterly Audit Data. 2018.
- Chow S, Seow CS, Dizon MV, et al. A clinician's reference guide for the management of atopic dermatitis in Asians. Asia Pac Allergy. 2018;8(4):e41.
- Kannenberg SM et al., S Afr Fam Pract 2020; 62(1): e1–9.
- Luger T et al., J Dermatol 2021; 48(8): 1139–48; DOI: 10.1111/1346-8138.15921.
Dosierung und Anwendung
![]()
Elidel® kann kurzzeitig zur Behandlung von Anzeichen und Symptomen eines atopischen Ekzems und intermittierend langfristig zur Prävention und Weiterentwicklung von Schüben verwendet werden.1
![]()
Eine Behandlung mit Elidel® sollte beim ersten Auftreten von Anzeichen und Symptomen einer atopischen Dermatitis beginnen. Elidel® sollte nur auf von der atopischen Dermatitis betroffenen Hautstellen angewendet werden. Der Patient oder die betreuende Person sollte Elidel® absetzen, wenn die Anzeichen und Symptome abgeklungen sind. 1
![]()
Daten aus klinischen Studien unterstützen die intermittierende Behandlung mit Elidel® für bis zu 12 Monate. 1
![]()
Wenn nach 6 Wochen keine Verbesserung auftritt oder sich die Erkrankung verschlimmert, sollte Elidel® abgesetzt werden. Die Diagnose einer atopischen Dermatitis sollte erneut bewertet werden und weitere therapeutische Optionen sollten in Betracht gezogen werden.1
Anwendung
![]()
Erwachsene Tragen Sie zweimal täglich eine dünne Schicht Elidel® auf die betroffene Haut auf und reiben Sie diese sanft und vollständig ein. Jede betroffene Hautregion sollte mit Elidel® behandelt werden, bis eine Besserung auftritt. Die Behandlung sollte dann abgesetzt werden.1
![]()
Pädiatrische Patienten
Für Kleinkinder (3 – 23 Monate), Kindern (2–11 Jahre) und Jugendlichen (12–17 Jahren) gilt die gleiche Dosierung und Art der Anwendung wie bei Erwachsenen. 1
![]()
Ältere Patienten
Atopische Dermatitis (Ekzem) tritt bei Patienten ab 65 Jahren selten auf. Klinische Studien mit Elidel® hatten keine ausreichende Anzahl von Patienten in dieser Altersgruppe eingeschlossen, um zu ermitteln, ob diese Patienten anders als jüngere Patienten ansprechen. 1
Elidel® kann in allen Hautbereichen angewendet werden, inklusive dem Kopf und Gesicht, Nacken und intertriginösen Bereichen, aber nicht auf Schleimhäuten. Elidel® sollte nicht unter Okklusion angewendet werden. 1
In der Langzeitbehandlung von atopischer Dermatitis (Ekzem) sollte die Elidel®-Behandlung bei dem ersten Auftreten von Anzeichen und Symptomen von atopischer Dermatitis beginnen, um Schübe der Erkrankung zu vermeiden. Elidel® sollte zweimal täglich angewendet werden. Rückfettende Pflegepräparate können unmittelbar nach der Anwendung von Elidel® verwendet werden.1
Referenz:
Kasuistik
1. Kasuistik: Pimecrolimus bei Säuglingen, aus dem Magazin „Kinder- und Jugendarzt“

Bei Säuglingen mit atopischer Dermatitis gibt es wenige antientzündliche Behandlungsoptionen, der Bedarf an nicht-kortikosteroiden Therapien ist auch im Hinblick auf die Kortikophobie hoch. Die Kasuistik von Dr. Barbara Kunz, Hamburg zeigt, dass mit der Zulassung des Calcineurin-Inhibitors Pimecrolimus ab dem 3. Lebensmonat1 diesem Bedarf Rechnung getragen wird.
PDF herunterladen2. Kasuistik
16-jähriger männlicher Patient, der unter Juckreiz im Gesicht litt und typische AD-Läsionen in den Ellenbogen und im Gesicht aufwies. Scores (6) der Globalen Bewertung durch den Prüfarzt (IGA) mit Visueller Analogskala (VAS) führten zu einer Diagnose einer leichten Erkrankung mit lokalisierten, erythematösen, abschuppenden Läsionen (Abbildung 1). Die persönliche und Familienanamnese zeigte, dass sowohl der Patient als auch seine Mutter zuvor mit Atopie (allergischer Rhinitis und Asthma) diagnostiziert wurden, was 3 Wochen lang mit mittelstarken topischen Kortikosteroiden behandelt wurde. 2
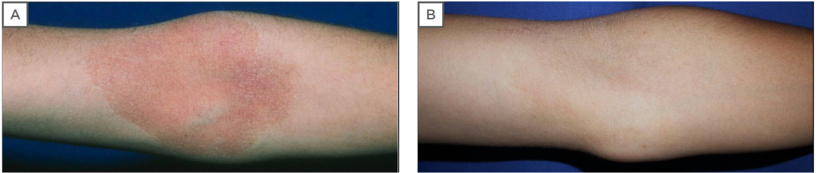
Abbildung 1: 16-jähriger männlicher Patient mit typischer atopischer Dermatitis-Läsion des Ellenbogenbereichs, zuvor behandelt mit topischen Kortikosteroiden mit vorübergehenden Ergebnissen.
A) Vor der Behandlung mit Elidel®-Creme (Pimecrolimus 1 %) zweimal täglich für 3 Wochen;
B) nach Behandlung mit kompletter Linderung.2
3. Kasuistik
Eine 31-jährige Frau zeigte klinische Merkmale leichter AD und Läsionen, die auf den inneren Canthus beider Augen lokalisiert waren (Abbildung 2 A–C). Sie litt auch unter Juckreiz des betroffenen Bereichs (VAS-Score: 6). Die Familienanamnese zeigte, dass ihr Vater mit AD diagnostiziert wurde, die gelegentlich mit kosmetischen Cremes behandelt wurde.2

Abbildung 2: Eine 31-jährige Frau mit atopischer Dermatitis auf den inneren Canthus beider Augen lokalisierter Läsionen.
A) Vor der Behandlung mit Elidel®-Creme (Pimecrolimus 1%) zweimal täglich 3 Wochen lang;
B–C) Details des rechten und linken Auges;
D) nach der Behandlung, komplette Linderung der Läsionen des linken Auges und entzündliche Restläsion des rechten Auges.2
Referenzen:
- Fachinformation Elidel
- Micali G. EMJ Dermatol. 2020;8[Suppl 5]:2-8.
Publikationen
Topical therapy of atopic dermatitis with a focus on pimecrolimus
Luger T et al. J Eur Acad Dermatol Venereol. 2021 Apr 8. doi: 10.1111/jdv.17272. Online ahead of print.

Abstract
Atopic dermatitis (AD) is a chronic and relapsing, inflammatory skin disease characterized by impaired skin barrier function and immune system dysregulation that results in dryness, skin microbiome dysbiosis and intense pruritus. It is highly heterogeneous, and its management is demanding. Patients with AD are at greater risk of comorbidities such as attention-deficit hyperactivity disorder as well as other atopic diseases. Early-onset AD cases typically improve or resolve in late childhood; however, it is proposed that the prevalence of persistent or adult-onset AD is higher than previously thought. Basic therapy consists of emollient application and trigger avoidance, and when insufficient, topical corticosteroids (TCS) are the first-line treatment. However, corticophobia/steroid aversion and TCS side-effects, particularly on sensitive skin areas, lead to low compliance and insufficient disease control. Several long- and short-term randomized controlled and daily practice studies have demonstrated that topical calcineurin inhibitors, such as pimecrolimus, have similar anti-inflammatory effects to low-to-medium strength TCS, reduce pruritus and improve the quality of life of patients. In addition, pimecrolimus does not cause skin atrophy, is steroid-sparing and has a good safety profile, with no evidence for an increased risk of malignancies or skin infections. In general, pimecrolimus cream is well-accepted and well-tolerated, encouraging patient adherence and leading to its use by many physicians as a preferred therapy for children and sensitive skin areas.
Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial
Bardur Sigurgeirsson et al. Pediatrics. 2015 Apr. . 2015 Apr;135(4):597-606. doi: 10.1542/peds.2014-1990. Epub 2015 Mar 23.

Abstract
Background and objectives: Atopic dermatitis (AD) primarily affects infants and young children. Although topical corticosteroids (TCSs) are often prescribed, noncorticosteroid treatments are needed because compliance with TCSs is poor due to concerns about their side effects. In this longest and largest intervention study ever conducted in infants with mild-to-moderate AD, pimecrolimus 1% cream (PIM) was compared with TCSs.
Methods: A total of 2418 infants were enrolled in this 5-year open-label study. Infants were randomized to PIM (n = 1205; with short-term TCSs for disease flares) or TCSs (n = 1213). The primary objective was to compare safety; the secondary objective was to document PIM's long-term efficacy. Treatment success was defined as an Investigator's Global Assessment score of 0 (clear) or 1 (almost clear).
Results: Both PIM and TCSs had a rapid onset of action with >50% of patients achieving treatment success by week 3. After 5 years, >85% and 95% of patients in each group achieved overall and facial treatment success, respectively. The PIM group required substantially fewer steroid days than the TCS group (7 vs 178). The profile and frequency of adverse events was similar in the 2 groups; in both groups, there was no evidence for impairment of humoral or cellular immunity.
Conclusions: Long-term management of mild-to-moderate AD in infants with PIM or TCSs was safe without any effect on the immune system. PIM was steroid-sparing. The data suggest PIM had similar efficacy to TCS and support the use of PIM as a first-line treatment of mild-to-moderate AD in infants and children.
Effectiveness and safety of a prevention-of-flare-progression strategy with pimecrolimus cream 1% in the management of paediatric atopic dermatitis
B Sigurgeirsson et al. J Eur Acad Dermatol Venereol. 2008 Nov. . 2008 Nov;22(11):1290-301. doi: 10.1111/j.1468-3083.2008.02785.x. Epub 2008 Jul 24.

Abstract
Objective: This study was performed to investigate the efficacy and safety of a prevention-of-flare-progression strategy with pimecrolimus cream 1% in children and adolescents with atopic dermatitis (AD).
Methods: A 26-week multi-centre, randomized, double-blind, vehicle-controlled study was conducted in 521 patients aged 2-17 years, with a history of mild or moderate AD, who were clear/almost clear of disease before randomization to pimecrolimus cream 1% (n = 256) or vehicle cream (n = 265). Twice-daily treatment with study medication was started at the first signs and/or symptoms of recurring AD. If, despite the application of study medication for at least 3 days, AD worsened (as confirmed by the investigator), treatment with a moderately potent topical corticosteroid (TCS) was allowed in both groups. The primary efficacy end point was the number of days on study without TCS use for a flare.
Results: The mean number of TCS-free days was significantly higher (P < 0.0001) in the pimecrolimus cream 1% group (160.2 days) than in the control group (137.7 days). On average, patients on pimecrolimus cream 1% experienced 50% fewer flares requiring TCSs (0.84) than patients on vehicle cream (1.68) (P < 0.0001). Patients on pimecrolimus cream 1% also had fewer unscheduled visits (87) than patients on vehicle cream (246).
Conclusions: In children and adolescents with a history of mild or moderate AD but free/almost free of signs or symptoms of the disease, early treatment of subsequent AD exacerbations with pimecrolimus cream 1% prevented progression to flares requiring TCS, leading to fewer unscheduled visits and reducing corticosteroid exposure.
Pimecrolimus cream 1% in the long-term management of adult atopic dermatitis: prevention of flare progression. A randomized controlled trial
H Gollnick et al. Br J Dermatol. 2008 May;158(5):1083-93. doi: 10.1111/j.1365-2133.2008.08484.x. Epub 2008 Mar 13.

Abstract
Background: Previous studies suggested that early intervention with pimecrolimus cream 1% at the first signs and/or symptoms of a relapse of atopic dermatitis (AD) following remission may prevent the occurrence of more severe flares and therefore reduce corticosteroid exposure in the long term. However, this possibility was not rigorously evaluated.
Objectives: To evaluate the effectiveness of pimecrolimus cream 1% for the prevention of flare progression in adults with AD.
Methods: A 26-week randomized controlled study was conducted in 543 patients aged>or=18 years, with a history of mild or moderate AD, who were clear/almost clear of disease before randomization to pimecrolimus cream 1% (n=277) or matching vehicle cream (n=266). Twice-daily treatment with study medication was started at the onset of the first signs and/or symptoms of a relapse. If disease worsened, despite the application of study medication for at least 3 days, treatment with a moderately potent topical corticosteroid (TCS) was allowed in both groups. The primary efficacy endpoint was the number of days without TCS use for disease worsening.
Results: The mean number of TCS-free days was significantly higher (P<0.001) in the pimecrolimus cream 1% group (152 days) than in the vehicle cream group (138.7 days). In comparison with vehicle cream, pimecrolimus cream 1% reduced the mean number of flares requiring TCS use from 1.39 to 0.97 (P=0.0014). Patients on pimecrolimus cream 1% made 30% fewer unscheduled visits (156) than patients on vehicle cream (223).
Conclusions: In adults with a history of mild or moderate AD but free of active skin lesions, intervention with pimecrolimus cream 1% at the first signs and/or symptoms of a subsequent recurrence reduces the number of flares requiring TCS use and decreases the number of disease-related office visits.
Efficacy and safety of pimecrolimus cream in the long-term management of atopic dermatitis in children
Ulrich Wahn et al. Pediatrics. 2002 Jul;110(1 Pt 1):e2. doi: 10.1542/peds.110.1.e2

Abstract
Objective: Pimecrolimus cream (SDZ ASM 981), a nonsteroid inhibitor of inflammatory cytokines, is effective in atopic dermatitis (AD). We assessed whether early treatment of AD signs/symptoms with pimecrolimus could influence long-term outcome by preventing disease flares.
Methods: Early intervention with pimecrolimus was compared with a conventional AD treatment strategy (ie, emollients and topical corticosteroids). In this 1-year, controlled, double-blind study, 713 AD patients (2-17 years) were randomized 2:1 to a pimecrolimus-based or conventional regimen. Both groups used emollients for dry skin. Early AD signs/symptoms were treated with pimecrolimus cream or, in the conventional treatment group, vehicle to prevent progression to flares. If flares occurred, moderately potent topical corticosteroids were mandated. The primary efficacy endpoint was ranked flares at 6 months. Safety was monitored clinically, and a skin recall-antigen test was performed at study completion.
Results: BASELINE CHARACTERISTICS OF THE PATIENTS: The mean age for both groups was approximately 8 years, and the majority of patients had moderate disease at baseline. PATIENT FOLLOW-UP AND EXPOSURE TO STUDY MEDICATION: The mean duration of follow-up (+/-standard error) was 303.7 (+/-5.30) days in the pimecrolimus group and 235.2 (+/-9.40) days in the control group. The discontinuation rate was significantly higher in the control group than in the pimecrolimus group (51.5% vs 31.6% at 12 months), and proportionately more patients with severe or very severe disease discontinued in the control group. The main reason for the higher discontinuation rate in the control group was unsatisfactory therapeutic effect (30.4% vs 12.4%). This resulted in a substantially higher mean number of study medication treatment days in the pimecrolimus group compared with the control group: 211.9 (69.8% of study days) versus 156.0 (66.3% of study days). Of those patients who completed 12 months on study, 14.2% and 7.0% of patients in the pimecrolimus and vehicle groups, respectively, used study medication continuously.
Efficacy: Patients in the pimecrolimus group experienced significantly fewer AD flares than those in the control group, according to the primary efficacy analysis on ranked flares of AD (Van Elteren test). The proportion of patients who completed 6 or 12 months with no flares was approximately twice as high in the pimecrolimus group compared with control (61.0% vs 34.2% at 6 months; 50.8% vs 28.3% at 12 months). Fewer flares were observed in the pimecrolimus group regardless of baseline disease severity, so even severe patients derived benefit from the treatment. The analysis of time to first flare showed that treatment with pimecrolimus was associated with a significantly longer flare-free period (log- rank test). Covariate analysis indicated a statistically significant effect on time to first flare of baseline Eczema Area and Severity Index score, and whether patients had "severe" or "very severe" disease at baseline according to the Investigators' Global Assessment, although patients in all baseline disease severity subgroups benefited from treatment. Age had no significant effect. Fewer patients in the pimecrolimus group required topical corticosteroid therapy compared with control (35.0% vs 62.9% at 6 months; 42.6% vs 68.4% at 12 months), and patients in the pimecrolimus group spent fewer days on topical corticosteroid therapy (57.4% vs 31.6% [pimecrolimus vs control, respectively] spent 0 days on topical corticosteroid therapy, 17.1% vs 27.5% 1-14 days, and 25.5% vs 41.0% >14 days over the 12 months of the study). This steroid-sparing effect of pimecrolimus was evident despite pimecrolimus-treated patients being on study longer than patients in the control group. The average proportion of study days spent on second-line corticosteroids was 4.08% in the pimecrolimus group and 9.10% in the control group. Analysis of Eczema Area and Severity Index over time showed significantly lower median scores, thus indicating better disease control in the pimecrolimus group compared with the control group. Similar results were obtained from analysis of the Investigators' Global Assessment (not shown). The treatment groups were well balanced with respect to the number of patients using antihistamines during the study (57.2% vs 62.9%, pimecrolimus vs control, respectively).
Safety: There were no appreciable differences between treatment groups in the overall incidence of adverse events. The most frequent adverse events were common childhood infections and ailments, including nasopharyngitis, headache, and cough. The incidence of suspected drug-related adverse events was not significantly different in the pimecrolimus group (24.7% vs 18.7%--pimecrolimus vs control), and the incidence of serious adverse events was low (8.3% vs 5.2%--pimecrolimus vs control). Life-table analysis of incidence of adverse events revealed no significant differences between the treatment groups, except for cough. Local tolerability was good in both treatment groups. The most common application site reaction reported was sensation of burning (10.5% vs 9.3%--pimecrolimus vs control). There were no major differences between treatment groups in the duration or severity of application site reactions, most of which were mild-to-moderate and transient, occurring within the first week of treatment. Skin infections were reported in both groups. There were no between-group differences in the life-table analysis of time to first occurrence of bacterial skin infections nor in the adjusted incidence of bacterial skin infections. Although there were no significant differences between treatment groups in the incidence of individual viral skin infections, the incidence of grouped viral skin infections (12.4% vs 6.3%--pimecrolimus vs control) showed a slightly higher incidence in the pimecrolimus group. Laboratory values and vital signs showed no significant between-group differences. There were no significant differences between treatment groups in response to recall antigens in those patients who remained on study for 12 months.
Conclusions: Treatment of early AD signs/symptoms with pimecrolimus was effective in preventing progression to flares in more than half the patients, reducing or eliminating the need for topical corticosteroids. The benefits were consistently seen at 6 months across important disease severity subgroups and with respect to the various predefined efficacy endpoints. Furthermore, these benefits were sustained for 12 months, providing evidence that long-term treatment with pimecrolimus leads to better control of AD. Treatment with pimecrolimus was well tolerated and was not associated with clinically relevant adverse events compared with the conventional treatment group. The results reported here offer the prospect of effective long-term management of AD with reduced need for topical corticosteroids.
Safety and efficacy of pimecrolimus (ASM 981) cream 1% in the treatment of mild and moderate atopic dermatitis in children and adolescents
Lawrence F Eichenfield et al. J Am Acad Dermatol. 2002 Apr;46(4):495-504. doi: 10.1067/mjd.2002.122187

Abstract
Background: The ascomycin derivative pimecrolimus (ASM 981) is a cell-selective cytokine inhibitor, specifically developed for the treatment of inflammatory skin diseases.
Objective: When applied topically, pimecrolimus cream 1% has shown promise as a treatment for inflammatory skin conditions, including atopic dermatitis (AD) in children and adults, allergic contact dermatitis, and chronic contact irritant hand dermatitis in adults.
Methods: In two independent 6-week, randomized, multicenter studies of identical design, the efficacy and safety of pimecrolimus cream 1% in children with predominantly moderate AD were compared with vehicle. Pooled data from a total of 403 patients were used in the analysis. The primary efficacy parameter was the Investigator's Global Assessment (IGA) score. Secondary parameters included Eczema Area and Severity Index (EASI) and severity of pruritus scores. Subjects were also asked to assess their disease control as uncontrolled, limited, good, or complete.
Results: Significant therapeutic benefits relative to vehicle were observed in the pimecrolimus-treated group at the first efficacy assessment, 8 days after initial application of the study medication (eg, relief of pruritus). At each subsequent postbaseline visit, pimecrolimus-treated patients showed significant improvement relative to controls in all efficacy measures. The medication was well tolerated.
Conclusion: Pimecrolimus cream 1% appears to be a safe and effective alternative to currently used therapies for AD.
Pimecrolimus cream in the long-term management of atopic dermatitis in adults: a six-month study
Michael Meurer et al. Dermatology. 2002;205(3):271-7. doi: 10.1159/000065863.

Abstract
Background: Pimecrolimus cream (Elidel, SDZ ASM 981), a non-steroid inhibitor of inflammatory cytokines, is effective in the treatment of atopic dermatitis (AD). We assessed whether early treatment of AD signs/symptoms reduces the need for topical corticosteroids.
Objective: To investigate the efficacy and safety of pimecrolimus cream 1% in the long-term management of adult AD.
Methods: 192 adults with moderate to severe AD were randomised (1:1) for twice daily (b.i.d.) treatment of early signs or symptoms of AD with either pimecrolimus cream 1% or vehicle cream (control group) to prevent progression to flares. Treatment was given as needed for 24 weeks. In the event of flares, a moderately potent corticosteroid (prednicarbate 0.25% cream) was permitted as rescue medication in both groups. The percentage of days on which a topical corticosteroid was used to treat disease flares was the main outcome measure.
Results: Corticosteroid medication was used on 14.2% (95% confidence interval, CI: 8.3-21.1) of the days of the 24-week treatment period in the pimecrolimus group and on 37.2% (95% CI: 30.4-44.0) of the days in the control group (p < 0.001). In total, 44.8% (43/96) of patients in the pimecrolimus group did not experience a flare compared with 18.8% (18/96) of patients in the control group. The median time to first flare was 144 days in the pimecrolimus group and 26 days in the control group (p < 0.001). Pimecrolimus treatment was also associated with improvement in signs and symptoms of AD, pruritus, patients' self-assessment and quality of life.
Conclusions: Pimecrolimus cream 1% b.i.d. is an effective, well-tolerated, long-term treatment for AD in adults, substantially reducing the number of flares compared to a conventional therapy and consequently reducing or eliminating the need for corticosteroid treatment.
Onset of pruritus relief with pimecrolimus cream 1% in adult patients with atopic dermatitis: a randomized trial
R Kaufmann et al. Allergy. 2006 Mar;61(3):375-81. doi: 10.1111/j.1398-9995.2005.00977.x.

Abstract
Background: Pimecrolimus cream 1% (Elidel, Novartis Pharmaceuticals AG) effectively improves/relieves pruritus associated with atopic dermatitis (AD), but few data are available regarding the timing of relief. The purpose of this study was to investigate the timing of pruritus relief produced with pimecrolimus in adults with mild/moderate AD and moderate/severe pruritus.
Methods: Patients were randomized to 7 days of treatment with pimecrolimus (n = 100) or vehicle (n = 98). Pruritus severity was assessed daily on a 4-point scale (0 = absent, 3 = severe), reflecting the previous 24 h experience. Patients who completed this core study were eligible to enter a voluntary 5-week, open-label extension study.
Results: A significant effect was noted within 48 h of treatment, with pruritus improving in 56% of pimecrolimus-treated patients and 34% of vehicle-treated patients (P = 0.003). Pruritus relief was maintained during the remainder of the core and extension phases, and was accompanied by an improvement in the Investigator's Global Assessment score.
Conclusion: Pimecrolimus cream 1% significantly reduced pruritus within 48 h.
Evaluation of the atrophogenic potential of hydrocortisone 1% cream and pimecrolimus 1% cream in uninvolved forehead skin of patients with atopic dermatitis using optical coherence tomography
Roland Aschoff et al. Exp Dermatol.. 2011 Oct;20(10):832-6. doi: 10.1111/j.1600-0625.2011.01335.x. Epub 2011 Jul 19.

Abstract
Topical corticosteroids are widely used to treat atopic dermatitis (AD), but their anti-inflammatory mode of action can be accompanied by several unwanted side effects including skin atrophy and telangiectasia. In this 8-week, investigator-blinded, intraindividual right-left comparison study with patients with mild-to-moderate AD, hydrocortisone 1% cream (HCT) was applied twice daily for 4 weeks on one side of forehead skin without clinical signs of AD and pimecrolimus 1% cream (PIM) on the other. Epidermal and dermal thickness were assessed by optical coherence tomography (OCT) and high-frequency ultrasound, respectively. Skin atrophy and telangiectasia were assessed by contact dermatoscopic photography (Dermaphot(®)). Treatment with HCT leads to a significant decrease in epidermal thickness after only 2 weeks of treatment, while the decrease in PIM-treated sites was less pronounced and was not statistically significant. By 4 weeks after the end of treatment, epidermal thickness returned to baseline values. No dermal thinning or development of telangiectasia could be observed by means of ultrasound or Dermaphot(®), respectively. In summary, this study indicates that a 2-week single course of topical treatment with a mildly potent steroid can cause transient epidermal thinning, an effect not seen in the PIM group. The slight decrease with PIM - although not significant - could be due to normalization of the increased skin thickness caused by a subclinical inflammation in AD. This study suggests that PIM may be safer for treatment of AD in sensitive skin areas like the face, especially when repeated application is required.
Different effects of pimecrolimus and betamethasone on the skin barrier in patients with atopic dermatitis
Jens-Michael Jensen et al. J Allergy Clin Immunol. 2009 Sep;124(3 Suppl 2):R19-28. doi: 10.1016/j.jaci.2009.07.015.

Abstract
Background: Genetic defects leading to skin barrier dysfunction were recognized as risk factors for atopic dermatitis (AD). It is essential that drugs applied to patients with AD restore the impaired epidermal barrier to prevent sensitization by environmental allergens.
Objectives: We investigated the effect of 2 common treatments, a calcineurin inhibitor and a corticosteroid, on the skin barrier.
Methods: In a randomized study 15 patients with AD were treated on one upper limb with pimecrolimus and on the other with betamethasone twice daily for 3 weeks.
Results: Stratum corneum hydration and transepidermal water loss, a marker of the inside-outside barrier, improved in both groups. Dye penetration, a marker of the outside-inside barrier, was also reduced in both drugs. Electron microscopic evaluation of barrier structure displayed prevalently ordered stratum corneum lipid layers and regular lamellar body extrusion in pimecrolimus-treated skin but inconsistent extracellular lipid bilayers and only partially filled lamellar bodies after betamethasone treatment. Both drugs normalized epidermal differentiation and reduced epidermal hyperproliferation. Betamethasone was superior in reducing clinical symptoms and epidermal proliferation; however, it led to epidermal thinning.
Conclusion: The present study demonstrates that both betamethasone and pimecrolimus improve clinical and biophysical parameters and epidermal differentiation. Because pimecrolimus improved the epidermal barrier and did not cause atrophy, it might be more suitable for long-term treatment of AD.
The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study
C Queille-Roussel et al. Br J Dermatol.. 2001 Mar;144(3):507-13. doi: 10.1046/j.1365-2133.2001.04076.x.

Abstract
Background: SDZ ASM 981 is a selective inhibitor of inflammatory cytokines released from T lymphocytes and mast cells, which has been developed for the treatment of inflammatory skin diseases.
Objectives: In the present study, the atrophogenic potential of SDZ ASM 981 1% cream in humans was compared with that of medium and highly potent topical steroids, and vehicle.
Methods: Four different preparations, SDZ ASM 981 1% cream, the corresponding vehicle of SDZ ASM 981 1% cream, betamethasone-17-valerate 0.1% cream and triamcinolone acetonide 0.1% cream, were applied to the volar aspect of the forearms of 16 healthy volunteers, twice daily, 6 days a week, for 4 weeks. Skin thickness was evaluated by ultrasound examination, clinical signs of atrophy by stereomicroscopy, and epidermal thickness was assessed by histology.
Results: Both topical corticosteroids induced a significant reduction in skin thickness, as compared with SDZ ASM 981 1% cream and vehicle, which were shown to be equivalent. The difference in skin thickness (measured by ultrasound examination) between patients treated with SDZ ASM 981 1% cream and those receiving either of the two topical steroids was significant from day 8 onwards. Histological analysis performed at day 29 showed significant epidermal thinning with topical steroids compared with SDZ ASM 981 1% cream or the vehicle. Conclusion The lack of atrophogenic properties of SDZ ASM 981 1% cream in this short-term study demonstrates its potential as long-term treatment for inflammatory skin diseases, thus overcoming a major drawback of topical steroids. This may also be important for the treatment of children, and sensitive areas of skin, such as the face and skin-
A randomized controlled trial of pimecrolimus cream 1% in adolescents and adults with head and neck atopic dermatitis and intolerant of, or dependent on, topical corticosteroids
D F Murrell et al. Br J Dermatol. 2007 Nov;157(5):954-9. doi: 10.1111/j.1365-2133.2007.08192.x.

StabiEL: stabilization of skin condition with Elidel--a patients' satisfaction observational study addressing the treatment, with pimecrolimus cream, of atopic dermatitis pretreated with topical corticosteroid
Harald Gollnick et al. J Eur Acad Dermatol Venereol. 2008 Nov;22(11):1319-25. doi: 10.1111/j.1468-3083.2008.02807.x. Epub 2008 Jun 6.
Abstract
Background: There is a need for alternative treatments for atopic dermatitis (AD) of the face and neck as long-term use of topical corticosteroids (TCS) is associated with skin atrophy and telangiectasia and some patients develop allergy, intolerance or other side-effects.
Objectives: This study was designed to assess the efficacy and safety of pimecrolimus cream 1% in patients with AD of the face and neck who are either dependent on, or intolerant of, TCS.
Methods: A 12-week study comprising a 6-week, double-blind, randomized, vehicle-controlled phase was conducted, followed by a 6-week, open-label phase. Two hundred patients aged 12 years or over with mild to moderate head and neck AD, intolerant of, or dependent on, TCS were randomized to either pimecrolimus cream or vehicle cream. The primary efficacy criterion was the facial investigator's global assessment score at 6 weeks. Secondary efficacy criteria were head and neck Eczema Area and Severity Index (EASI), pruritus score and eyelid dermatitis. Facial skin atrophy and telangiectasia were assessed with dermatoscopy.
Results: A significantly higher percentage of patients treated with pimecrolimus was cleared or almost cleared of facial AD compared with vehicle (47% vs. 16%, respectively). A statistically significant difference was also seen on head and neck EASI and pruritus score. Significantly more pimecrolimus-treated patients than vehicle-treated patients achieved clearance of eyelid dermatitis (45% vs. 19%, respectively). Among the 77 patients with skin atrophy at baseline, treatment with pimecrolimus was associated with a reversal in skin thinning. Of the 112 patients with telangiectasia at baseline, no statistically significant difference was seen between treatment groups. Adverse events occurred with similar frequency in both groups.
Conclusion: Pimecrolimus cream 1% is effective in patients with head and neck dermatitis intolerant of, or dependent on, TCS. Reversion of skin atrophy may occur during TCS-free intervals.

Abstract
Background: The objective of this 4-month multicentre observational study was to evaluate safety and efficacy of intermittent long-term treatment of patients with atopic dermatitis (AD) with pimecrolimus cream 1% in the daily practice and to compare it with the preceding topical corticosteroid-based therapy in retrospective.
Patients and methods: Overall severity of AD and individual symptoms were assessed in 3200 patients by the physician, whereas acceptance of treatment and satisfaction of patients was investigated using a patient questionnaire.
Results: The percentage of patients clear or almost clear of symptoms increased from 12% to 82%. Seventy-four per cent of physician rated the treatment better than the preceding therapy, and 21% noted no difference. Seventy-seven per cent of the patients asserted that long-term intermittent treatment with pimecrolimus reduces the frequency of flares as opposed to less than 27% for topical corticosteroids. Patients also felt that pimecrolimus results in a higher improvement in quality of life; 84% stated that pimecrolimus stabilized the skin compared with 27% for topical steroids.
Conclusion: Intermittent treatment of AD patients with pimecrolimus cream 1% is effective and well tolerated, and results in higher patient satisfaction compared with topical corticosteroids in retrospective
A randomized investigator-blinded study comparing pimecrolimus cream 1% with tacrolimus ointment 0.03% in the treatment of pediatric patients with moderate atopic dermatitis
Steven Kempers et al. J Am Acad Dermatol.2004 Oct;51(4):515-25. doi: 10.1016/j.jaad.2004.01.051.

Abstract
Objective: To evaluate pimecrolimus cream 1% and tacrolimus ointment 0.03% in pediatric patients with moderate atopic dermatitis (AD).
Methods: 141 patients (aged 2-17 years) were randomized to treatment with pimecrolimus cream 1% (n=71) or tacrolimus ointment 0.03% (n=70) twice daily for 6 weeks.
Results: At day 4, local, application-site reactions were less common and of shorter duration with pimecrolimus than with tacrolimus. Incidence of erythema/irritation was 8% (6/71) with pimecrolimus compared with 19% (13/70) with tacrolimus (P=.039). Fewer patients receiving pimecrolimus (0%, 0/6) experienced erythema/irritation lasting >30 minutes, compared with those receiving tacrolimus (85%, 11/13; P <.001). Fewer patients reported itching with pimecrolimus (8%; 6/71) than with tacrolimus (20%; 14/70; P=.073). Incidence of warmth, stinging, and burning was similar in both groups; however, reactions lasting >30 minutes were fewer with pimecrolimus (0%, 0/14) than with tacrolimus (67%, 8/12; P <.001). More patients receiving pimecrolimus rated ease of application as 'excellent' or 'very good', compared with tacrolimus (76% vs 59%, respectively; P <.020). Efficacy was similar in both groups at day 43. Both treatments were generally well tolerated with no unexpected adverse events.
Conclusion: Pimecrolimus cream 1% had better formulation attributes and local tolerability than tacrolimus ointment 0.03% while providing similar efficacy and overall safety in pediatric patients with moderate AD.
Percutaneous absorption of drugs used in atopic eczema: pimecrolimus permeates less through skin than corticosteroids and tacrolimus
Andreas Billich et al. Int J Pharm. 2004 Jan 9;269(1):29-35. doi: 10.1016/j.ijpharm.2003.07.013.

Abstract
For treatment of skin diseases with topical drugs, penetration of the agents into the relevant layers of the skin is required. Permeation through the skin should, however, be kept to a minimum, in order to avoid the risk of systemic side effects. Here we compared the in vitro skin penetration and permeation of two novel drugs used in the therapy of atopic eczema (pimecrolimus and tacrolimus) and three representative corticosteroids (betamethasone-17-valerate, clobetasol-17-propionate, and diflucortolon-21-valerate). Drug concentrations of pimecrolimus and corticosteroids in human skin were found to be in the same order of magnitude. Permeation of pimecrolimus through human skin was, however, lower by factors of 70-110 as compared to the steroids. When pimecrolimus was compared with tacrolimus in human, pig, or rat skin, similar concentrations of the two compounds were measured in the skin, whereas permeation of pimecrolimus through skin was consistently lower by factors of 9-10. Lipophilicity was found to be highest for pimecrolimus, its octanol-water distribution coefficient being higher by factors of 8 and 25-450 than that of tacrolimus and the corticosteroids, respectively. The low permeation of pimecrolimus may be explained by its higher lipophilicity (compared to tacrolimus and the corticosteroids) and higher molecular weight (compared to steroids). In conclusion, pimecrolimus appears to have a favourable skin penetration/permeation profile, featuring a low degree of percutaneous absorption
Pimecrolimus in atopic dermatitis: consensus on safety and the need to allow use in infants
Thomas Luger et al. Pediatr Allergy Immunol.. 2015 Jun;26(4):306-15. doi: 10.1111/pai.12331. Epub 2015 Apr 13.

Abstract
Atopic dermatitis (AD) is a distressing dermatological disease, which is highly prevalent during infancy, can persist into later life and requires long-term management with anti-inflammatory compounds. The introduction of the topical calcineurin inhibitors (TCIs), tacrolimus and pimecrolimus, more than 10 yr ago was a major breakthrough for the topical anti-inflammatory treatment of AD. Pimecrolimus 1% is approved for second-line use in children (≥2 yr old) and adults with mild-to-moderate AD. The age restriction was emphasized in a boxed warning added by the FDA in January 2006, which also highlights the lack of long-term safety data and the theoretical risk of skin malignancy and lymphoma. Since then, pimecrolimus has been extensively investigated in short- and long-term studies including over 4000 infants (<2 yr old). These studies showed that pimecrolimus effectively treats AD in infants, with sustained improvement with long-term intermittent use. Unlike topical corticosteroids, long-term TCI use does not carry the risks of skin atrophy, impaired epidermal barrier function or enhanced percutaneous absorption, and so is suitable for AD treatment especially in sensitive skin areas. Most importantly, the studies of pimecrolimus in infants provided no evidence for systemic immunosuppression, and a comprehensive body of evidence from clinical studies, post-marketing surveillance and epidemiological investigations does not support potential safety concerns. In conclusion, the authors consider that the labelling restrictions regarding the use of pimecrolimus in infants are no longer justified and recommend that the validity of the boxed warning for TCIs should be reconsidered.
Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I
A Wollenberg et al. J Eur Acad Dermatol Venereol.. 2018 May;32(5):657-682. doi: 10.1111/jdv.14891.

Abstract
This guideline was developed as a joint interdisciplinary European project, including physicians from all relevant disciplines as well as patients. It is a consensus-based guideline, taking available evidence from other guidelines, systematic reviews and published studies into account. This first part of the guideline covers methods, patient perspective, general measures and avoidance strategies, basic emollient treatment and bathing, dietary intervention, topical anti-inflammatory therapy, phototherapy and antipruritic therapy, whereas the second part covers antimicrobial therapy, systemic treatment, allergen-specific immunotherapy, complementary medicine, psychosomatic counselling and educational interventions. Management of AE must consider the individual clinical variability of the disease; highly standardized treatment rules are not recommended. Basic therapy is focused on treatment of disturbed barrier function by hydrating and lubricating topical treatment, besides further avoidance of specific and unspecific provocation factors. Topical anti-inflammatory treatment based on glucocorticosteroids and calcineurin inhibitors is used for flare management and for proactive therapy for long-term control. Topical corticosteroids remain the mainstay of therapy, whereas tacrolimus and pimecrolimus are preferred in sensitive skin areas and for long-term use. Topical phosphodiesterase inhibitors may be a treatment alternative when available. Adjuvant therapy includes UV irradiation, preferably with UVB 311 nm or UVA1. Pruritus is targeted with the majority of the recommended therapies, but some patients may need additional antipruritic therapy. Antimicrobial therapy, systemic anti-inflammatory treatment, immunotherapy, complementary medicine and educational intervention will be addressed in part II of the guideline.
Referenzen:
- Eichenfield LF, Tom WL, Berger TG, et al. Guidelines of care for the management of atopic dermatitis: section 2. Management and treatment of atopic dermatitis with topical therapies. J Am Acad Dermatol. 2014;71(1):116-132.
- 2. Werfel T, Schwerk N, Hansen G, Kapp A. The diagnosis and graded therapy of atopic dermatitis. Dtsch Arztebl Int. 2014;111(29-30):509-i.
- Wollenberg A, Barbarot S, Bieber T, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018;32(5):657-682.
- Chow S, Seow CS, Dizon MV, et al. A clinician's reference guide for the management of atopic dermatitis in Asians. Asia Pac Allergy. 2018;8(4):e41.
Downloads im Bestellshop
Servicematerial bestellen und herunterladen
Fachinformation Elidel® 10mg/g Creme
Referenzen:
Weiterführende Inhalte
Downloads im Bestellshop

Downloads zu Elidel und atopischer Dermatitis für Patienten und Ihre Praxis finden Sie im Bestellshop
Dermatologische Erkrankungen
Die Haut – ein dynamisches Organ, das vom Säuglings- bis Seniorenalter von vielen Erkrankungen betroffen sein kann

